3年前、空港のレストランで夫と一歳になる双児の子どもたちと食べていたとき、はじめて発作に襲われた。この時、私の人生は混沌の奈落の底に突き落とされた。その時に起きた発作、そして、その後、何度となく繰り返し起きた発作の数々。しかし、発作そのものは問題ではない。発作のさなか、わたしは意識がなく、何も知らないのだから。問題は、発作と発作の間。毎日、頭の中は幾度となく繰り返される同じ疑問であふれかえる。今日は発作なしでやっていけるかしら?子どもたちは大丈夫かしら?なぜ、よりによって、こんなことが、わたしの身に降りかからなくてはいけなかったの?子どもたちもてんかんを発症するのかしら?昔のように元気がでてこないのは、なぜ?いつかは、こんなこともなくなるのかしら?
原発性全般てんかん罹患 26歳主婦
Lowenstein LH. Pathways to discovery in epilepsy research: Rethinking the quest for Cures. Epilepsia 49: 1-7, 2008
発作がなくなったからといって、すぐに歩き出せるわけではありません。正常であることの重荷(Burden of normality)、よくなったことの重荷(Burden of Wellness)があるのです。発作がなくなったあとも、家族、医療、福祉が見守ってあげなくてはなりません。
日本てんかん学会元理事長 八木和一 先生
目次
迷走神経刺激法(Vagus Nerve Stimulation:VNS)
脳深部刺激療法Deep brain stimulation (DBS) 1
正常であることの重荷(Burden of normality)、よくなったことの重荷(Burden of Wellness)
てんかん発作をみたら
てんかん発作を引き起こす脳内の異常電気活動は、一旦、発生すると、てんかん発作を抑え込む薬を急速に血管内に入れない限り、途中で止まることは、まず、ありません。しかし、この異常放電は脳の抑制機能によって、ほとんどが、数分以内に勢いを失い、消えていきます (発作を停止させる脳の自己制御機構の実態については、まだよくわかっていません。異常放電による激しいエネルギー消費によって脳が酸性に傾くことが抑制神経細胞群を活性化させるなどといった説が提唱されていますが、十分に検証されているとはいえません)。
逆に、何かしたからといって発作を止めることもできません(ただし、てんかん発作に「慣れた」人の中には、てんかん発作が起きそうになると、つまり、前兆を感じると、発作が起こるのを何とか止めようとして、成功することがあるようです。つまり、単純部分発作から複雑部分発作や強直間代発作への進展を意識的に食い止めることができるらしいのです。ことの性質上、実証は難しいですが)。
てんかん発作、とくに、突然叫んで、頭を後ろに反らせ、顔を歪め、口唇を震わせ、手足を硬直させる全身痙攣を目の当たりにすると、大声で名前を呼んだり、体を揺すったりして、何とか発作を止めたくなります。しかし、残念ながら、これはあまり役に立ちません。発作による異様な運動によけいな動きを加えてしまい、かえって、危険です。
それよりも、まず、安全なところに寝かせてあげてください。衣服がきつそうであればゆるめてください。そして、吐物が喉に詰まらないよう、顔を横に向けてあげましょう。
そして、あとは、何もしないでください。
激しい痙攣のときは、唇は真っ青、身体は硬直して、とても息をしているようにはみえません。このまま死んでしまいはしないかと泡を食ってしまいます。しかし、けいれん発作だけが原因で死ぬことは、めったにありません。そのことを、頭の片隅に入れておいていただければ、いざというとき、少しは気持ちを落ちつけられるのではないでしょうか。
脳炎、髄膜炎、脳内出血などでけいれんを起こし、不幸にして亡くなる方がみえます。しかし、これは、脳炎や髄膜炎、脳内出血というきわめて重篤な疾患が死因であって、けいれんそのものは直接の死因ではありません。
けいれんそのものが死に直結することがまったくないというわけではありません。しかし、きわめてまれです。
ただし、間接的にてんかん発作が死につながることがときとしてあります。
溺水です。
とくに、入浴が危険です。
ゆったりとした気分でお風呂につかっていると、神経細胞網の警戒も緩んでしまうせいでしょうか、てんかん発作が起きやすくなります。とくに、年頃の女の子ですと、お風呂に入るとき、内側から鍵をかけてしまうことがめずらしくありません。しかし、これでは、いざというとき助けることができません。湯船につかっている最中の発作が溺水死に直結してしまいます。てんかん発作が十分にコントロールされていない方は、原則として、誰もいない状況で一人だけでお風呂に入らないようにしてください。何かあったらすぐにお風呂に飛び込んで助け出す人が、どうしても必要です。もし、それがかなわぬのであれば、シャワーで済ますのが無難です。
入浴中に比べ、水泳中はてんかん発作による溺水死が少ないことが知られています。水泳中は、気が張っていて、てんかん発作が起きにくいためでしょう。しかし、水泳中の発作が全くないというわけではないので、注意は怠らないでください。一人で泳ぐのは絶対に避けてください。お風呂のときと同じように、誰かがそばについているときだけ、泳ぐようにしてください。
何もしないでください、といいましたが、痙攣を目撃したら、どんな発作なのか、よく観察だけはしてください。眼の位置や動き、表情、顔色、四肢の動き、意識の有無(呼びかけに反応するかどうか)を確認してください。その情報がてんかん発作かどうかを判断する重要な、そして、多くの場合、唯一の手がかりになるのですから。
舌を噛む?
もう40年以上も前のことですが、てんかん発作を起こしたお子さんが口の中を血だらけにして救急車で病院に運ばれてくることがありました。発作で舌をかんだと思われるかもしれませんが、違います。舌をかむといけないというので、お母さんが無理やり口の中に箸やスプーンを入れようとしたためです。そのため、箸やスプーンの先っぽが口の中の粘膜を傷つけ、出血していたのです。
痙攣中、ものすごい力で歯を噛みしめることがあります。そうなると、簡単には口の中に箸やスプーンを入れることはできません。それを強引にこじ開けようとしたものですから、その結果がこれです。指を血だらけにしたお母さんが、けいれんを起こした子供さんを連れて来られたこともあります。舌をかまないよう、指で口をこじ開けようとしたのです。
当時、てんかん発作中に舌をかむことがあるので、割り箸やスプーンを口の中に差し込んで舌をかまないようにしろ、と書いた本が、どうやら、あったようです。看護師さんでも、古い方は、痙攣というとガーゼを巻いた舌圧子を患者さんの口に突っ込もうとしたものです。看護師さんの教科書にそうしろと書いてあったようです。授業でもけいれんのときには舌圧子を入れるよう教えられたそうです。
なぜ、そんなことが看護師さんの教科書にまで書かれるようになったのか、経緯はわかりません。しかし、さすがに最近の教科書には、そんなことは書かれていないようです。
たしかに、きわめてまれに、てんかん発作で舌をかむことはあります。しかし、舌をかむのはてんかん発作が始まった直後がほとんどです。てんかん発作に気づいて、舌をかまないようにしても手遅れです。むしろ、口にいろんなものをつっこんで、舌をのどの奥に追いやってしまい、窒息させてしまうことの方がよほど心配です。そこまでいかなくても、先ほどのお母さんたちのように、無理やり箸やスプーンやフォークを歯の間からこじ入れようとして、歯ぐきや口腔粘膜を傷つけ、口の中を血だらけにしてしまったり、指をねじ込んで噛まれてしまったり、いずれにしろ、ろくなことはありません。
ところが、一般の人々954人に聞いた意識調査では発作の時「口に何か詰める」という回答が58%にみられたという報告がなされています。しかし、これだけは、決してやらないで下さい。
| 発作には、どんな対処をしたら よいと思いますか? n=954 | ||
| 口に何か詰める | 557 | 58% |
| 抑える | 47 | 5% |
| 救急車を呼ぶ | 445 | 47% |
| 見守る | 421 | 44% |
| 気道を確保 | 316 | 33% |
| 病院に連れて行く | 164 | 17% |
| 名前を呼ぶ | 84 | 9% |
| 身体をゆする | 31 | 3% |
| 日本てんかん協会(1998) てんかんに対する市民意識調査 | ||
てんかん発作のとき舌を噛むという神話は、どうやら、万国共通のようです。海外におけるてんかんに関する意識調査でもこの神話の存在が示されています。そして、「痙攣のとき決して余計なものを口の中に入れないようにしましょう」というのも、世界中のてんかん専門医が必ず口にする注意事項です。
それよりも、てんかん発作をみたら、まず、時計を見てください。
主観的時間は客観的時間と大きなずれを生じます。心理状態によって主観的時間が揺れ動くからです。同じ1分でも、あっという間に過ぎてしまうこともあれば、なかなか時間が流れず、10分にも20分にも感じられることがあります。てんかん発作を目の前にすると、気が動転し、周りの情景も一変、あたかも時の流れが止まったように感じられます。10秒が1分に、1分が10分に、5分が1時間に思えてしまいます。そのような状況での客観的時間は、時計で確認するしかありません。発作の持続時間はてんかん発作かどうかを決めるうえでも、発作型を判断するうえでも、きわめて重要な情報です。
てんかんについて書かれた啓発書を開くと、たいてい、てんかん発作をみたら、まず、落ち着くこと、と書かれています。
しかし、実際に、けいれんを目の前にして冷静でいられるかといえば、なかなか、そうはいきません。それまで普通にしていた家族や知り合いが、突然、目をつり上げ、表情を一変、真っ青になって奇声を発し、身体を硬直させるのです。そんな発作を目の当たりにすれば、慣れた医者でも、いささか不安になるものです。
そういう場合、何もしないで、ただ、呆然として、みているだけ、というのが一番まずい対応です。動転し、焦り、不安が募るばかりです。そういうとき、何かほかにやることがあれば、少し、気が紛れます。時計を見て「まだ、たった20秒しか経っていない」と確認するのは、心を落ち着かせる一つの方策です。先に述べた、安全なところに寝かせるというのも、患者さんのためになることはもちろんのこと、その作業が、見守る側にとっての精神安定剤になります。
てんかん発作重積の治療
きわめて稀に、発作が止まらなくなることがあります。脳には発作を停止させる機能があるはずなのですが、これが破綻をきたしたり、あるいは、発作を長引かせる何らかの機構が惹起されたりして、延々と発作が続いてしまうことがあるのです。これをてんかん発作重積状態といいます。
ただ、時間的にどれだけ発作が続けば重積状態とするかについては、今も、意見が分かれています。
82分以上けいれんが続くと興奮毒性によって神経に修復不能な障害が生じるという半世紀以上前の動物実験の結果(Meldrum BS, Horton RW(1973))などをもとに、30分以上続いたら重積状態とする意見が長く続いていました。しかし、その後の研究調査から、20分以上という定義が採用されたこともありました。
ところが、結局のところ、現在、発作の持続時間をどう設定すべきかについて、十分な根拠に基づいた結論は得られていません。
しかし、それでは困るので、2015年、国際抗てんかん連盟(ILAE)が膨大なデータをもとに重積発作についての暫定的な定義を発表しています(表1)。この定義では、発作型によって持続時間が異なっていて、2種類の持続時間が定められています。
この2種類の時間とは、これ以上発作が続くと発作が自然に止まる可能性が低くなる時間(T1:発作継続閾値時間)と、発作による興奮毒性によって神経細胞が障害され、脳に機能障害を残す時間(T2:細胞障害閾値時間)です。発作継続閾値時間を超えると、発作が止まる可能性が低くなり、発作頓挫のためには医療的介入が必要となります。細胞障害閾値時間を超えると、後遺症の可能性も考えなければなりません。
発作の形によってこの時間は異なり、全身けいれん(強直間代けいれん)の発作重積では発作継続閾値時間は5分、細胞障害閾値時間は30分と考えられています。一方、焦点性てんかん重積では、発作継続閾値時間は10分、細胞障害閾値時間は60分とされています。また、欠神発作重積では発作継続閾値時間が10~15分で、細胞障害閾値時間は不明となっています。一般の方にとって発作型の鑑別は難しいですから、てんかん発作らしきものが5分以上続いた場合、発作が止まらない可能性が高いため、適切な行動を取る必要があると覚えておいて下さい。
| 表1 てんかん発作重積状態に対して治療を開始すべき発作持続時間、および、長期にわたる影響が残る可能性がある発作持続時間の暫定指標 (ILAE Tinka et al (2015)) |
| てんかん発作重積の型 | 発作が持続する可能性が 高まる発作持続時間 | 神経細胞障害、神経細胞死、神経細胞網の変容、機能欠失によって長期にわたる影響が残る恐れが高まる発作持続時間 |
| 強直間代てんかん 重積発作 | 5分 | 30分以上 |
| 意識を伴う焦点性 てんかん重積発作 | 10分 | 60分以上 |
| 欠神発作重積発作 | 10-15分 | 不明 |
てんかん重積状態を終わらせるには、静脈に針を刺し入れ、てんかん発作を抑える薬を静脈に注入するのが、一番確実です。注入する薬としては、ベンゾジアゼピン系薬剤であるジアゼパム(商品名:セルシン、ホリゾン)が長年使われてきました。
ジアゼパムの静注は歴史上画期的な治療法で、きちんとしたデータはありませんが、てんかん重積発作で亡くなったり、後遺症が残ったりすることがこの治療の登場以降ずいぶん減っただろうと推定されています。
ただ、ジアゼパムは呼吸抑制をはじめとした注意を要する副作用があり、やや、使いにくい面があります。それに、すべてのてんかん重積状態に有効というわけではありません。このため、近年では、ロラゼパム(商品名:ロラピタ静注)、そして、小児ではミダゾラム(商品名:ミダフレッサ)といった同じベンゾジアゼピン系の静注用製剤もてんかん重積状態の第一選択薬として使われるようになってきています。そして、これで効かなければ、ホスフェニトイン(商品名:ホストイン)、フェノバルビタール(商品名:ノーベルバール)、レベチラセタム(商品名:レベチラセタム点滴静注)、それに、成人にはミダゾラムも試みられます。しかし、こうした二の矢でもコントロールできない場合は、思い切った対応が必要となります。麻酔剤などでてんかん発作を起こせないぐらいに脳の機能を低下させるのです。チオペンタール(商品名:ラボナール)、チアミラール(商品名:イソゾール)といったバルビツール酸誘導体やプロポフォールなどがこの目的に使用されます。さらに、ミダゾラムを血管内に流し続けるということも行われます。この段階になると、薬による呼吸抑制が強く、気管内挿管を行って、呼吸器で呼吸を補助する必要もでてきて、集中治療室ICUでの治療が必要となります。
以上述べた処置は、もちろん、医療機関でなければ行えません。ですから、てんかん重積状態になったら、まずは、救急車を呼ぶことになります。しかし、いつも救急車を呼ぶというのは大変ですし、近くに適切な処置ができる病院がないということだってありえます。そこで、とりあえず、医療機関以外でできそうな対応法がいろいろ考案されてきました。日本でこれまでによく使われてきたのが、ジアゼパムの直腸内投与です。ジアゼパム注射液を直腸粘膜から吸収させて発作を止めようというのです。ジアゼパム液は比較的急速に直腸から吸収されるので、これは結構有効です。ただ、日本では直腸から入れるジアゼパム製剤は座薬しかありませんでした。座薬ですと注射液に比べ吸収が遅く、最高血中濃度に達するまでに30分、下手をすると、1時間ぐらいかかり、てんかん重積状態を阻止するのにはちょっと非力です。じつは、ジアゼパム注射薬を使った治験も最初は行われたのですが、家庭で使うのには不便だと考えられたのでしょう、座薬に変更されてしまったという経緯があります。発作は止められなくても、発作再発抑制には有効なのですが、てんかん重積状態での使用には疑問符がついていました。しかし、最近になって鼻粘膜にジアゼパム液を噴霧する薬(商品名:スピジア点鼻液 https://passmed.co.jp/di/archives/19627)が日本で製剤化されました。すでに、海外では同じ製剤が実用化されていて、その使用経験からは発作抑制までの時間が平均4分とされています。坐薬よりも体内への吸収、効果発現が速いことが分かります。それに、坐薬は小児用に製剤化されていましたが、これは成人でも使用可能です。
ただ、スピジア点鼻薬登場以前からジアゼパムの直腸投与に代わる製剤が日本では実用化されていました。ミダゾラムの口腔内注入薬です。口腔粘膜からミダゾラム注射液を体に吸収させる薬剤です。この投与方法は1966年頃から欧州で考案され、実用化されていましたが、日本でブコラムという名で商品化されたのは最近のことです。ミダゾラム液の入った注射器の先を口腔内の頬の内側あたりに入れるだけで(ブコラムのブコはラテン語で頬を意味します)静脈確保などは必要ありませんから、医療機関以外の場でも簡単に行うことができます。スピジア点鼻液同様、発作が長引きそうであれば、主治医と相談のもと、とりあえず、家庭でもやってみる価値があります。ただ、両者の優劣については、どのような場面でどのように使うかということも含め、まだ十分には比較検討されていません。年を経て、両者の位置づけも決まってくるでしょうから、それまでは、試行錯誤の中で使用していくことになるのかもしれません。てんかん発作重積は患者さんにも患者さんの家族にも重大な影響を及ぼす可能性がありますから、そこに至る前になんとか阻止することが望ましく、この2剤も含めてさまざまな方法であらかじめ予防する方策も現在検討されています。
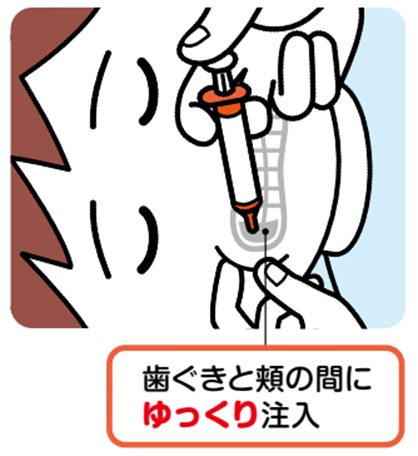
| 図1 ミダゾラム液(ブコラム)の使い方 武田薬品工業株式会社作成ガイドブックから https://www.buccolam.jp/patients/common/images/pdf/1-5-2929.pdf |
| 第1段階 | 第2段階 | 第3段階 | |
| 血糖値60mg/dl以下の場合 静脈確保 | 塩酸チアミン100mg+50%ブドウ糖50ml | ホスフェニトイン 22.5mg/kg 静注 150mg/分以下 または フェノバルビタール 15-20mg/kg 静注 100mg/分以下 または ミダゾラム 0.1–0.3mg/kg 静注 (小児 1mg/分) その後 0.05-0.4mg/kg/時 持続静注 または レベチラセタム 1,000–3,000mg 2–5mg/kg/分で (小児 20–60mg/kg 最大3,000mg) | ミダゾラム 0.05-0.4mg/kg/時で持続静注 (小児 0.1- 0.5 mg/kg/時) または プロポフォール 1-2mg/kg 静注 有効であれば 2-5mg/kg/時で持続静注 (小児では禁忌) または チオペンタール 3–5mg/kg 静注 有効であれば 2-5mg/kg/時で持続静注 または チアミラール 3–5mg/kg 静注 有効であれば 2-5mg/kg/時で持続静注 |
| 静脈確保 | ジアゼパム 50-10mg 5mg/分 (小児 0.3-0.5 mg/kg) ロラゼパム 4mg 2mg/分 (小児 0.05mg/kg 最大4mg) (小児ではミダゾラム 0.1-0.3 mg/kg 最大4mg) | ||
| 静脈確保が 困難の場合 | ミダゾラム口腔内投与 ジアゼパム静注液直腸投与 10-30mg (小児 0.2-0.5 mg/kg) | ||
| 表2 てんかん重積状態の治療 (日本神経学会 てんかん診療ガイドライン2018 一部改変) |
てんかん重積状態は一刻も早く何らかの対応をしなくてはいけません。ですから、こんなことが起こるてんかんという病気は不気味なものにみえるかもしれません。しかし、てんかん重積発作はめったに起きません。てんかん重積状態の年間発症率は 100,000人に対し18.3人とされており、15 歳未満の小児に限っていえば日本では100,000人に対し38. 8人にすぎません。しかも、てんかん重積状態の半分は急性脳症などのてんかん以外の急性期疾患において起きています。ですから、てんかんにおける発生頻度はさらにその2分の1ということになります。それに、重積状態に陥りやすいてんかんというのは限られ、ある程度予測がつきます。不幸にもそうしたてんかんに罹患していることが判明したら、主治医と相談して何分続いたら救急車を呼ぶか、あるいは、先ほどのスピジア点鼻薬やブコラムなどを使った対策を協議しておくとよいでしょう。しかし、それ以外は、きちんと薬を飲んでいればてんかん重積状態に陥る可能性はほぼゼロといってもいいと思います。
てんかん重積状態を過度に恐れる必要はありません。
てんかん治療
以上は、てんかん発作が止まらないときの話で、てんかん重積状態の治療はてんかん診療において欠かせない対処法ではありますが、てんかんの治療というと、一般的には、てんかん発作が繰り返さないよう阻止する方法のことをいいます。そして、その意味でのてんかんの治療としては、現在、薬物治療、外科治療、食事療法の3つが行われています。
しかし、そうした一般的な治療に加え、てんかんの原因であるさまざまな病気(とくに、脳の疾患)への対応、そして、合併症への対策も大切です。とくに、合併する運動障害、知的障害、精神障害に対する支援、対策は、患者さんの生活の質を改善するためにきわめて重要です。さらに、てんかんやその原因疾患によってもたらされる家庭生活、社会生活への悪影響を緩和するための福祉的対処、生活支援も必須です。てんかんを発症した中でどのような生活を送っていくかという視点に立つならば、訓練、合併精神症状の治療、生活支援はてんかん発作の再発防止と同じぐらい大事な対策です。
しかし、ここでは、てんかん発作再発を食い止める、一般的な意味でのてんかん治療に話を絞って述べます。
薬物療法
現在、てんかん治療の多くは薬によって行われています。てんかん発作を起きにくくする薬、抗てんかん薬を服用し、てんかん発作再発の可能性を下げるのです。てんかん薬物療法の有効率は結構高く、抗てんかん薬を服用することによって、てんかんをもつ方の6~7割では、2年以上、てんかん発作がない状態を保つことができます。
てんかんをもっていらっしゃる方のご家族、あるいは、医療関係者、特別支援学校の先生、障害者施設の職員の方たちは別ですが、一般の方で、てんかん発作を目撃した経験をおもちの方はあまりいらっしゃらないのではないでしょうか。私自身、てんかん診療に30 年以上携わっていますが、病院以外の場でてんかん発作をみたことはありません(病院外でてんかん発作を唯一「目撃」したのはテレビのスポーツ番組においてでした。ラグビーの試合で、ボールを奪い合って選手同士が空中で激突、頭を強く打った選手が、その後、痙攣しているのをカメラが映しだしていました)。てんかんが100人から200人に1人にみられるありふれた病気であることを考えると、日常生活の中でてんかん発作を目撃する機会がそれほど少ないのは不思議な気がします。しかし、おそらく、それは、薬によってほとんどの方で発作がコントロールされているためだと思われます。実際、まだ、抗てんかん薬治療が今ほど普及していなかった時代には、てんかん発作を目撃する機会は結構あったようです。「小学校のクラスに一人はてんかんで倒れる子がいた」という話を大正生まれの母から聞いたことがあります。昔はそんなものだったようです。
このように、抗てんかん薬は絶大な効果を発揮します。
しかし、抗てんかん薬は、てんかんの原因そのものを治しているわけではありません。てんかん発作をおきにくくしているだけです。腫瘍、脳の瘢痕、脳奇形などてんかんの原因となる器質性脳病変、てんかん発作がおきやすい体質、遺伝素因が抗てんかん薬でとりのぞかれるわけではありません。この意味で、てんかんの薬物療法は「対症療法」といえます。
このことは、たとえば、鉄欠乏性貧血の治療と比較して考えていただけると理解しやすいかもしれません。
鉄欠乏性貧血は、文字どおり、体内の鉄分が不足するために、鉄を原料としている赤血球が減ってしまう病気です。そこで、鉄欠乏性貧血の治療では鉄剤を服用していただきます。不足している鉄分をおぎなってあげるのです。鉄が補充されると赤血球の造血が急速に増加、貧血は解消します。この鉄剤服用という治療は、体内の鉄不足という根本原因を矯正するものですから、根治療法ということになります。
これに対し、原因はともかくも、とりあえず、輸血によって赤血球を補ってしまおう、というのが対症療法です。赤血球を補えば、どんな原因の貧血でも、いったんはよくなります。しかし、原因に対しては、何の対策も講じていません。このため、補った赤血球が消費されれば、また、貧血に逆戻りです。たとえば、再生不良性貧血という病気があります。血液成分を造る骨髄が変調をきたしておきる重篤な疾患です。それほど重い病気でも輸血をすれば一時的に貧血は解消します。しかし、輸血によって骨髄の異常が改善するわけではありません。輸血を繰り返しおこなわなければ、すぐに貧血状態に逆戻りしてしまいます。
抗てんかん薬による治療は、この輸血に当たります。てんかん発作の根本的原因を治しているわけではありません。抗てんかん薬の服用を中止すれば、再びてんかん発作は起きやすくなります。そして、てんかん発作が舞い戻ってきます。
注)このように、てんかん診療に用いられる薬のほとんどはてんかん発作を抑制するだけで、てんかんを治療しているわけではありません。このため、抗てんかん薬antiepileptic drug(AED)ではなく、抗てんかん発作薬、あるいは、抗発作薬 antiseizure medication (ASM) という名称が2017年に国際抗てんかん連盟(ILAE: International League Against Epilepsy)によって提起されました。このため日本でも、最近、てんかん専門医の間では抗発作薬 ASM と呼び習わすようになっています。しかし、抗発作薬という用語は一般の医者の間でさえ、まだまだ、一般的とは言えませんので、以下では従来の抗てんかん薬という用語を用います。
| メモ1 疾患修飾治療(Disease Modifying Therapy(DMT)) 根治治療に近いといえるてんかん薬物療法がないわけではない。けいれんそのものに対抗するのではなく、薬物によっててんかんの原因(病因)に直接働きかけて疾患を変容させ、それに伴い、てんかん発作も抑制する治療法である。たとえば、ピリドキシン依存性てんかんではビタミンB6、複合カルボキシラーゼ欠損症ではビオチンが疾患そのものに働きかけて種々の症状の発現を食い止め、それにともなっててんかん発作も抑制する。 また、結節性硬化症は細胞の成長分化を促進するmTOR経路を制御するtuberin、hamartinタンパク質をコードする遺伝子の異常によって発症するが、これに対し、mTOR経路を抑制するエベロリムスが結節性硬化症に合併する上衣下巨細胞性星細胞腫(SEGA)、腎血管筋脂肪腫を縮小させるだけでなく、発作軽減にも寄与することがわかってきている。このような治療は、薬物による疾患修飾治療(Disease Modifying Therapy (DMT))として今後も発展が期待されている。しかし、DMTはてんかんの薬物療法において、現在のところ、ごく少数派である。 |
てんかん発作がおこりやすい状態というのは、そうすぐにはなくなりません。ですから、てんかん発作がおこりやすい状態が続いている間は抗てんかん薬を服用し続ける必要があります。最低でも2年、たいていは数年以上にわたって毎日欠かさず服薬しなくてはなりません。1年間発作がなかったから、もう治った、と思って服薬をやめてしまい、もし、そこで、発作が再発したら、それまで薬を飲み続けた1年間の苦労は水の泡です。
発作頻度など、さまざまな要因によって異なりますが、一般的には、最低2年間、抗てんかん薬を飲み続け、その間、発作がなく、半年から一年ぐらいの間隔で記録した脳波で棘波などのてんかん放電がみられなくなれば、てんかんがおきにくくなったと考え、薬をゆっくり減量します。だいたい、これが、標準的なてんかんの薬物治療です(図1)。
しかし、これは、あくまでも原則です。例外はいくらでもあります。もっと短い治療期間ですむこともあれば、何十年と飲み続けなければいけないこともあります。そのすべてのケースをここで述べることは不可能ですので、個々の例については、主治医の先生にお聞きください(しかし、何年飲み続ければよいのか、正確に予測をすることは、主治医も、多くの場合、できませんが)。
てんかん発作が2か月に1回起きていたのであれば、薬を飲み始めて3~4カ月発作がない時点で、薬が効いている可能性がでてきます。ところが、1年に1回程度しか発作がみられなかった場合、薬が効いているかどうかは最低2年ぐらいみないと分かりません。抗てんかん薬を数年飲み続ける必要があるのは、このように、薬が本当に効いているかどうか確認するのに手間取ることも一因です。貧血であれば、赤血球が不足していないかどうかは血液検査で瞬時に分かるのですが、てんかんの場合、指標は、てんかん発作の有無しかありません。ですから、どうしても気長に待たざるをえないのです(脳波も重要な指標にはなりますが、あくまでも補助手段です)。
ただし、欠神発作のように一日に何回も発作がある場合、薬によって発作が止まったかどうかがすぐわかります。その場合には脳波も見ながら、もっと早く、1~2年で薬を減量できることもあります。
このように、薬が効いているかどうかを確認する期間は、薬を服用前の発作頻度によって大きく変わります。
発作が消失し、薬が効いていることを確認しなければ、治療をそれ以上続けるべきかどうかは判断できません。そして、しばらく薬を飲み続け、脳波なども参考にしながら、てんかん発作のおこり易さが低下したかどうか少し様子をみることになります。それから、ようやく、徐々に薬を中止していきます。
このように、最低数年という原則はあるものの、抗てんかん薬の投与期間というのは一人一人異なり、個別に判断することになります。
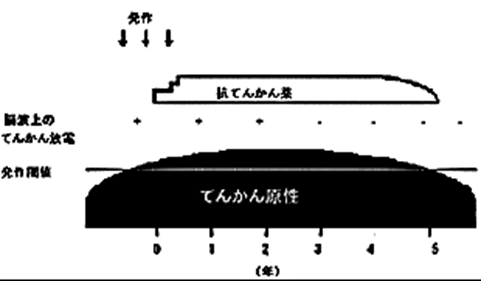
| 図1 標準的なてんかん薬物治療 てんかんの起こりやすさ(てんかん原性)が閾値を超えると、発作が起き、脳波上もてんかん放電がみられるようになる。これに対し抗てんかん薬の服薬を開始すると、発作が消失する。発作がない状態が数年続くと、てんかん原性が低下し、脳波も正常化する場合がある。すると、抗てんかん薬の服薬も中止できる可能性が出てくる。ただし、これは、あくまでも、標準的な治療概念で、個々の病状によって、治療内容は変わる。 |
一定期間、発作がなければ、徐々に薬を減量し、中止すると言いましたが、本当に薬を中止してもいいかどうかの判断も、さまざまな要因が複雑に絡み合うため、一筋縄ではいかない難しい作業です。専門医にとっても、その決定はむずかしく、ほとんどの場合、「正解」はないとさえいえます。たとえば、減量しても絶対発作が起きないと太鼓判を押せるのは、ほんの一部のてんかん症候群だけです。多くは、50%の確率で発作は再発しない、といった確率論的なお話しかできません。
まず、ある一定期間、発作がない状態が続いた時、薬の減量によってどの程度発作が再発するかですが、これは、てんかんの種類によって異なります。しかし、だいたい、12%から66%ぐらいといわれています。とてつもなく幅が広く、このデータだけでは何の決定もできません。
ただ、逆から言うと、少なくとも4割弱の確率で薬を中止しても発作が再発しないことになります。
しかし、この4割弱という数字を高いとみるか、低いとみるか、その判断は患者さんによってさまざまでしょう。てんかん発作再発が生活に及ぼす影響が患者さんによって異なるからです。社会に出て普通に働いている人が仕事中に痙攣発作を起こした場合、その人の社会生活に計り知れない影響を及ぼす恐れがあります。また、車を常時運転する人にとって、てんかん発作の再発はあってはならないものです。一方で、まだ小学生の子が、睡眠中だけの発作の再発をきたしたとしても、学校生活にあまり支障をきたさないかもしれません。
このように、抗てんかん薬の減量中止にかんしては、多くの、しかも、不確定な要因を考慮する必要があります。それらを全てをここで述べることはとてもできません。具体的には、担当医と相談しながら決めていただくことになります。
したがって、以下は、あくまで、さまざまなてんかんの患者さんを一括りにしてみた場合の、抗てんかん薬の減量中止にかんする概略です。
まず、どのくらい治療を続けたら減量を考えるべきか、です。
先ほど申しましたが、これは、てんかんの種類によって異なります。しかし、一般的には、2年というのが一つの目安になっています。2年間、薬を服用していただいて、発作がなければ、とりあえず、減量を考えましょうということです。ただ、この2年という期間、一部の小児てんかんをのぞいて、実は、はっきりした根拠があるわけではありません。しかし、何はともあれ2年治療を続け、それから、まず、減量については考えてみよう、というのが世界中のてんかん専門医の共通認識になっています。
減量を考えるに際して、一番信頼がおける判断材料は、てんかんの病因、または、てんかん症候群です。たとえば、脳腫瘍でてんかん発作が起きている場合、原因となる腫瘍を取り除かない限り、発作が繰り返す確率は高いままです。あるいは、中心側頭部に棘波をもつ良性小児てんかん(別名、ローランドてんかん)を代表とする小児特発性部分てんかんの場合、2年発作が止まっていれば、薬を減量しても、発作はほとんど再発しないことがわかっています。一方で、若年性ミオクロニーてんかんは薬の減量によって、100%とは言いませんが、かなりの確率で、再発します。
このように、減量してもよいもの、すべきでないものがはっきりしているてんかんの病因、あるいは、てんかん症候群があります。しかし、再発率についてここまで明確にいえるてんかん症候群はほんの一部です。実質的には、上に挙げた二つだけといってもいいくらいです。それ以外のてんかんについては、たとえば、再発率40~50%といった曖昧な数字しかありません。中にはそうした再発率さえもわからないことがあります。さらに、どのてんかん症候群に分類したらいいかわからないてんかんを有している患者さんもたくさんみえます。
しかし、その場合でも、減量に際しての発作再発率に影響を及ぼすさまざまな要因がわかっていますから、それらをある程度参考にすることはできます。
たとえば、小児期発症のてんかんに比べ、思春期以降発症のてんかんは再発率が高いことが知られています。
また、発作型では、ミオクロニー発作、あるいは、強直間代発作がみられるてんかんで再発率が高いとされています。
さらに、知能障害や運動障害など脳に何らかの器質性異常が疑われる併存症状をおもちの方、治療開始後にもしばらくの間てんかん発作がみられた方、発作コントロールに2種類以上の抗てんかん薬を使わざるをえなかった方、減量開始時にまだ脳波異常が残存している方では、減量によって発作が再発しやすいことがわかっています。
一方で、5年以上発作がみられなかった方では発作再発率が低いことも知られています。
しかし、いずれの場合も確率論的なことしかいえないわけで、結局、一部のてんかん症候群をのぞいて、抗てんかん薬の減量は一種の「賭け」にならざるをえません。
減量については、さらに、気がかりな点があります。
不幸にして、薬の減量によっててんかん発作が再発した場合、とりあえず、減量以前に発作をコントロールしていた薬を、同じ量、もう一度服薬していただくことになります。しかし、その場合、以前と同じように、その薬によって発作がコントロールされるのかという点が気になります。
さいわい、これについては、約8割が以前の薬で再び発作がコントロールされることがわかっています。
しかし、あとの2割では、残念ながら以前のような寛解状態には戻れず、もとの量の薬を飲んでも、発作がくり返しみられることになります。ただ、そうした減量後に難治な経過をたどる方は、内側側頭葉てんかん、皮質形成異常のように、てんかんの起こりやすさがしだいに増大(痙攣域値が低下)していくと推定されるてんかんを有していることがほとんどです。こうしたてんかんは、減量せずに薬を飲み続けたとしても、遅かれ早かれてんかん発作が再発した可能性があります。実際、そうした病変によるてんかんの場合、2年間発作がない状態が続いたあと、さらに薬を飲み続けても、1-2割の方は、どこかの時点で発作が再発することがわかっています(図3、4)。
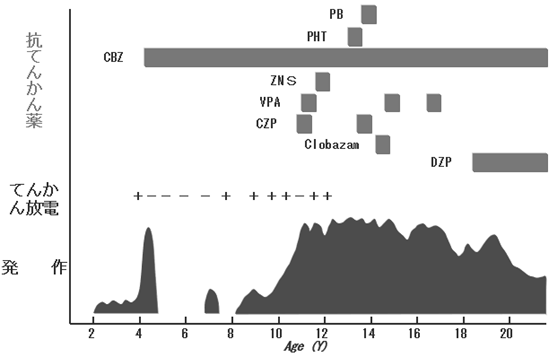
| 図3 21歳 男 症候性前頭葉てんかん 皮質形成不全 2歳頃から、アゴをガクガクさせ、その後左上肢を挙上、口唇、顔面を震わせ、意識が消失する発作が日に数十回頻発。カルバマゼピン(CBZ)で発作は一旦コントロールされたが、2年後に再発。その後、7種類の薬を試みたが発作がコントロールされず、20歳の時、皮質形成不全の皮質切除術が行われ、発作はようやく消失した。 |
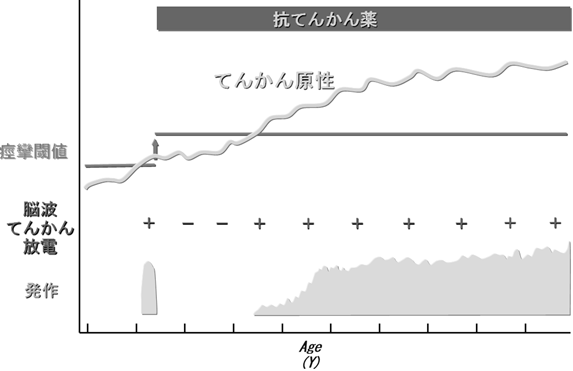
| 図4 難治性てんかんの時間経過 皮質異形成異常や海馬硬化に起因するてんかんの一部は、てんかん原性(てんかんの起こりやすさ)が進行性に上昇していくのかもしれない。このため、当初、薬で一旦発作がとまるものの、てんかん原性があるレベルを超えると、薬が何も効かなくなり、原因となる皮質を切除するしかなくなると考えられる。 |
減量を始めると、どの時点で発作が再発しやすいか、というのも知っておきたいところですが、これについても、ある程度はわかっています。
てんかん発作の再発の約半数は減量開始後半年以内に、9割は減量開始後1年以内にみられます。薬の減量はだいたい半年から一年ぐらいかけてゆっくり行います。ですから、再発の大半は減量中に起きます。これに対し、減量後2年以上たってからの再発はまれです。ですから、減量が終わって、全く薬を飲まなくなって1-2年たてば、とりあえず一安心、ということになります。逆に、薬を減量中、もしくは、薬を中止してから半年以内は用心する必要があり、たとえば、車の運転などは控えていただくことになります。
薬の減量中止にあたっては、もう一つ留意すべきことがあります。抗てんかん薬は中枢神経に働きかける薬ですから、抗てんかん作用以外にもいろいろな神経機能に対する薬理作用(と副作用があります)。このため、薬を止めると、抗てんかん薬以外の薬効によって抑えられていた神経症状が再び顔を覗かせるようになることがあります。たとえば、バルプロ酸は片頭痛の予防や双極性障害の症状緩和にも使われています。このため、バルプロ酸を止めると、頭痛がひどくなったり、精神的に不安定になったりする可能性があります(頭痛を訴えられない小さい子の場合、不機嫌になるという形で症状としてでることがあるかもしれません)。ですから、発作が再発していなくても、減量に伴って何か変だと思ったら担当医に相談して下さい。
てんかん発作消失よりも生活の質の向上
てんかん発作が2回以上繰り返しみられれば抗てんかん薬の服用を考慮する――これが、てんかん治療の原則です。なぜなら、1回目の発作がみられたのち5年以内にもう一度てんかん発作がみられるのは35%にすぎないという報告があるからです。つまり、半数以上が、薬を飲まなくても5年、もしくは、5年以上発作がない可能性があるわけです。
となると、とりあえず、薬を飲まずにおこうということになります。
ただし、35%という数値は平均値で、再発率が高いてんかんもあります。とくに、高齢発症てんかんでは再発率が高く、90%という報告すらなされています。ですから、高齢発症の場合、1回目ですぐに薬の服用を開始することが推奨されています。それ以外にも、脳病変、家族歴、発作型によっては再発率が高くなります。そうした方は1回の発作で薬を飲み始めるか担当医と相談していただくことになります。ただし、その決定にはご本人やご家族の考え、それに、社会的要因も絡んできますから、どうしたらいい、と一概には言えません。専門医にとっても、やはり、「正解」はありません。
2回発作が起きた場合、その次に発作が起きる確率は73%に跳ね上がります。ですから、たいていの場合、ここで、薬の服用を開始します。しかし、2回以上発作がみられたら、ぜったい薬を飲まなくてはいけない、というわけでもありません。
病気になると、その病気特有の症状が現れます。しかし、てんかんに限ったことではありませんが、治療の目標は必ずしもそうした症状を完全に消し去ることではありません。病気や症状が生活を阻害することを食い止めること、これが、最終目標です。てんかん治療でも同じです。てんかん発作を抑える薬を飲むかどうかは、てんかん発作の日常生活への影響、薬の副作用など、さまざまな要因を考慮して決定する必要があります。なんとしてでも薬を飲んで発作を止めなくてはならない、というわけではありません。
そこで、てんかん発作が2回、3回と繰り返した場合でも、抗てんかん薬による治療を見合わせることがありえます。
たとえば、入眠期に口角がひきつるような発作が数十秒みられるだけで、すぐに、再び寝入ってしまい、翌朝はケロッとしている、という予後の良い自然終息性小児てんかん症候群が知られています。このてんかん症候群では、治療しても、しなくても、成人してからの知的能力に差がないことが判明しています。発作は寝ているときだけで、生活にほとんど影響がなく、しかも、長期的な影響もないのですから、治療しない選択肢もありえます。
このように、てんかん発作が繰りかえしみられるからといって、必ずしも、全員、治療しなくてはならないということはありません。てんかん発作そのものではなく、生活全体をみて、治療方針は決定されます。
このような視点は、薬剤抵抗性てんかんにおいても大切です。
さまざまな抗てんかん薬を試しても、20~30%の患者さんでは、残念ながら、発作を完全にコントロールすることができません。そうした患者さんの一部では、あとで述べる、外科治療やケトン食療法によって発作が消失する可能性があります。しかし、そのような非薬物療法の対象にならない薬剤抵抗性てんかん、あるいは、非薬物療法によっても発作がコントロールされない難治てんかんでは、てんかん発作が止まらない状態が長く続くことになります。こうした難治てんかんの患者さんでは、てんかん発作を繰り返す中で、できる限り普通の生活ができるよう、治療戦略を練り直す必要があります。いうまでもありませんが、治療によって治療前より生活の質が落ちてしまっては何にもなりません。
ちなみに、以前は、薬剤治療で発作がコントロールできない場合、すべて、難治てんかんと定義していましたが、現在は考え方が変わってきています。薬を飲んで、年に数回、生活に困らないような軽い発作がある場合は、薬剤治療抵抗性であっても、難治てんかんとはいいません。つまり、薬剤抵抗性てんかんの一部を難治てんかんと考えようというのです。
では、何をもって薬剤抵抗性てんかんと言うのかというと、とりあえず、2種類薬を使ってみて止まらなければ、ということになっています。なぜ2剤かというと、1剤抗てんかん薬を使うと50%で発作コントロールされますが、2剤目でコントロールされるのはぐっと下がって13%で、それ以降は、3-9剤加えてもわずか5%しかコントロールされないからです。ですから、2剤で発作が止まらなければ、一度立ち止まって、本当にてんかん発作なのか、てんかんを起こす隠れた脳の異常はないのかなどを検討する必要があります。
とりあえず、てんかんの専門施設に紹介してもらうのも一つの方法です。1剤目で発作が止まる50%という値は、もちろん平均値です。たとえば、脳に器質異常のあるてんかん患者さんではコントロール率もぐっと下がります。2剤で止まらない場合、こうした病変が隠れている可能性が高いので、そのことも含めて、専門病院に紹介して評価してもらうのは悪くはない考え方でしょう(ついでながら、薬剤抵抗性てんかんを時間軸で考える専門医もいます。2年以上薬を試みても発作が続くと薬剤抵抗性てんかんと呼ぼうというのです。これは、最終的に薬でコントロールされた人の74%は1年以内に、11%が2年以内に発作が止まったというデータを根拠にしています)。
てんかん発作を100%コントロールすることは、じつは、可能です。
とてつもなく大量に抗てんかん薬をつかえば、いかなる発作も止めることができます。大量の薬で脳の神経細胞活動をゼロに近くまで押さえ込み、神経細胞が異常放電を形成できなくしてしまうのです。ただし、脳の機能も無に等しい状態になります。当然、通常の日常活動は不可能です。発作は起きませんが、一日中ボーッとして眠ってばかりということになります。
それが治療の名に値しないことは、いうまでもありません(ただし、きわめて難治で、発作が何十回と群発し、てんかん重積発作になるような方では、まれに、そうした方法をとることもあります。しかし、あくまでも、緊急避難的治療です。発作の再発を抑える通常のてんかんの治療では、もちろん、そんなことは論外です)。
このような極端な例では、話もわかりやすいのですが、実際には、もっと微妙な判断が必要になります。
薬物治療には薬の副作用という負の部分がつねについてまわります。しかし、そのマイナス面を帳消しにしてくれるだけの「治療効果」があるのであれば、その「治療」を選択することになります。
しかし、この比較は簡単ではありません。発作による不利益と副作用による不利益とは性質が異なるからです。異質なものを比較することはできません。その上、薬による不利益であれ、発作による不利益であれ、単純に計量化することもできません。患者さんや保護者の方の価値判断によって不利益の尺度は違ってきます。
発作を完全にコントロールできないのであれば、次善の策として、生活にもっとも支障のある発作に狙いを定めます。たとえば、睡眠時発作と覚醒時発作がある場合には、覚醒時発作に狙い定めて薬を調節する、といった具合です(ただし、それさえも容易な業ではありませんが)。
そして、ともかくも、それで、うまくいけば、一応は、一歩前進です。
しかし、そうした治療戦略もうまくいかないことがしばしばです。そうなると、副作用のことは二の次にして、とにかく発作をなくそう、という方向に傾きがちです。こうして、発作はある程度コントロールされたものの、学校に通っていても授業中ずっと寝ている、という状態になってしまいます。
結局、こうした厳しい状況では、患者さんにとって何が優先されるのか、その時その時で悩みながら試行錯誤していくしかありません。残念ながら、なかなか「正解」はみつかりません。
副作用恐怖症
しかし、だからといって、薬の副作用をやたらと恐れるのも考えものです。
たしかに、どんな治療にも、副作用はつきものです。そして、副作用によって、治療前に比べ、生活の質が落ちてしまっては何にもなりません。それが治療の名に値しないことはいうまでもありません。しかし、薬物療法においては、多くの場合、副作用は、無視できる程度のものがほとんどです。もし、副作用がみられたとしても、何とか対処できるほど軽微で、薬の効果による生活の質の改善による利点が圧倒的に勝っているものです。そもそも、そうでなければ、その薬が「治療薬」として認定され、市場にでてくるはずがありません。とくに、古い抗てんかん薬は、副作用に比べ、てんかん発作抑止効果とそれによる生活改善効果が圧倒的に勝っていたからこそ、長い年月、抗てんかん薬として生き残ってきたのです。
そのような薬を、副作用を過度に恐れるあまり、あきらめてしまうのは、もったいないことです。
過度の副作用恐怖症に陥らないことも大事です。
急激な断薬の危険性-反跳現象(リバウンド)
副作用に関連して、もう一つ、ご注意申し上げたいと思います。
前にも言いましたように、抗てんかん薬は年単位で飲み続ける必要があります。ところが、発作のない状態が一年も続くと、発作の恐怖より副作用への不安のほうが勝ってきて、自己判断で服薬を突然中止される方が、ときにいらっしゃいます。
しかし、これは、きわめて危険です。
急に断薬すると、以前の発作よりもずっとひどい発作が起きるおそれがあるからです。
フェノバルビタールなどでよく知られた現象ですが、急激な断薬によって、制御不能のてんかん重積状態に陥ることさえあります。抗てんかん薬によって長期にわたって発作を抑制していたため、押さえがなくなると、反動で、いつも以上のひどい発作に発展してしまうのだろうと推定されています。抗てんかん薬によって押さえつけられ押し込められていた脳内の「てんかんエネルギー」が解き放たれるのです。反動によって弾け跳ぶ現象ということで、反跳現象(リバウンド現象)と呼ばれています。コントロール不能となった発作によって、最悪の場合、死に至るおそれさえあります。くれぐれも、自己判断で、突然、薬を中止することだけはおやめください。
抗てんかん薬の種類
てんかん発作を抑制する薬、抗てんかん薬は現在、25品目ぐらいが日本で市販されています(日本では、さまざまな理由から、認可抗てんかん薬の種類が諸外国に比べ少ない状態が続いていましたが、最近、改善してきました。しかし、世界的には30品目以上の抗てんかん薬が認可され、処方されていて、日本はまだそれに追いついていません)。さらに、日本では向精神薬として認可されているクロラゼプ酸(メンドン)、クロキサゾラム(セパゾン)などのベンゾジアゼピン系薬剤も抗てんかん作用を有していることが知られており、ときとして、抗てんかん作用を期待して使われることがあります(ただし、日本においては抗てんかん薬としての保険適用はありません。プレギャバリン(リリカ)も欧米では抗てんかん薬の範疇に入れられていますが、日本では疼痛治療薬とされ、てんかんに対する保険適用がありません)。さらに、チオペンタール(ラボナール)、チアミナール(イソゾール、チトゾール)などのバルビツレート系麻酔剤やミダゾラム(ミダフレッサ、ミダゾール、ドルミカム、ブコラム)、抱水クロラール(エスクレ坐薬、注腸キット)が、前にも言いましたように発作の頓挫やてんかん重積状態の治療に使われています。そうした薬品にもっとも古い抗てんかん薬、臭化カリウム(ブロム)を含めると、現在日本で利用可能なてんかん治療薬は30種類以上にのぼることになります。しかし、このうち、よく使われている抗てんかん薬はせいぜい20種類前後です。
薬は作用機序、化学構造などによってさまざまなカテゴリーに分類されます。そして、抗てんかん薬においても作用機序、化学構造を基にした分類が試みられています。
イオンチャンネル作動薬
てんかん発作は神経細胞の異常興奮によって起こります。抗てんかん薬はそのてんかん発作が起きにくくなるようにするわけですから、神経細胞の興奮性に何らかの影響を及ぼすであろうことは容易に想像できます。神経細胞の興奮性は神経細胞を包む細胞膜が電気的にどのような状態にあるかによって規定されます。そして、多くの抗てんかん薬は神経細胞の細胞膜の電位にさまざまな影響を及ぼすことがわかっています。
神経細胞は細胞膜を通じてナトリウム、カリウム、塩素、カルシウムといった電解質を吸い込んだり、吐き出したりして細胞膜内外の電位を変化させ、その電気信号によって情報を伝達しています。そして、これによって神経細胞網に電流が生じているのです。そうした電解質の出入りは、当然ながら、秩序だったかたちでおこなわれる必要があります。このため、電解質の出入りはさまざまな方法で厳密に制御されています。しかし、万が一、その制御に狂いが生じると、電解質が無秩序に神経細胞膜を出入りするようになってしまいます。こうして、神経細胞網が一斉に昂奮状態になり、異常電流(てんかん発射)が生じ、てんかん発作が起きるのだろうと考えられています。
細胞膜の電気活動は細胞内外のナトリウム、カリウム、クロール、カルシウムなどの電解質の濃度によって規定されますが、そうした電解質は細胞膜上にあるイオンチャンネルという関門を通じて出入りします。このため、細胞膜の興奮性はこのイオンチャンネルによって大きく左右されます(イオンチャンネルは特殊な構造のタンパク質で細胞膜内外の電解質の濃度勾配や電位差にしたがって電解質を通過させますが、膜電位の変化(電位依存性チャンネル)やγアミノ酪酸(GABA)、アセチルコリンなどの特定の化学物質の存在下で(リガンド依存性チャンネル)、電解質の通過度が変わるものもあります。電解質はイオンチャンネルのそうした制御下で自然に細胞膜を通過しますが、一方で、エネルギーを使って能動的に電解質を移動させるタンパクも細胞膜には存在して、トランスポーター、あるいは、ポンプと呼ばれています。
たとえばナトリウムのイオンチャンネルが無秩序にナトリウムを通過させてしまうと、細胞内外の電位差が縮小してちょっとしたことで脱分極が起こりやすくなり、細胞の興奮性が高まる恐れがあります。実際、重症乳児ミオクロニーてんかんをはじめとしてさまざまなてんかんにおいてナトリウムのイオンチャンネルの一つに異常がみつかっています。逆に、従来使われてきたカルバマゼピン,フェニトイン、ラモトリギンなどの抗てんかん薬は、このナトリウムチャンネルの働きを鈍らせて抗てんかん作用を発揮していることが分かってきています。新たな抗てんかん薬、ラコサミドもナトリウムチャンネルに影響を及ぼします。ただ、ナトリウムチャンネルを鈍らせる道筋はいくつもあって、動作機序もいろいろで、それぞれに抗てんかん薬のナトリウムチャンネルへの影響が異なります。このため、ナトリウムチャンネルに異常がある重症乳児ミオクロニーてんかんではナトリウム作動性抗てんかん薬カルバマゼピン、フェニトインがかえって悪影響を及ぼすことがあります。
カリウムチャンネルに関しては良性家族性新生児てんかんの患者さんでチャンネルを制御する遺伝子に変異がみつかっています。このてんかんは生まれてすぐにけいれんを繰り返しますが、次第に発作がみられなくなり、運動障害、知的障害をきたさない予後のいい疾患です。あとで述べるγアミノ酪酸(GABA)の抑制作用が発達することによって発作が消失していくのだろうと推定されています。
一方、カリウムチャンネルの異常によって脳梁や基底核に異常をきたして発達が遅れ、発作も止まらない予後不良のてんかんも知られています。さらに、難聴、腎臓障害を伴うてんかんがカリウムイオンチャンネルの異常で起きることが分かっています。日本ではまだ発売されていませんが、海外ではカリウムチャンネルに関与して発作を起こりにくくするレチガビン(Retigabine)という薬が実用化されています。
カルシウムチャンネルは神経同士が接するシナプスに遍在し、神経細胞の電気活動に影響を及ぼしています。とくに、欠神発作と関係が深いとされている視床の異常発火に深く関与しているようです。事実、小児欠神てんかん、あるいは、欠神発作を合併する若年性ミオクロニーてんかんでは、カルシウムチャンネルの遺伝子変異が報告されています。その一方で、欠神てんかんに有効なエトサクシミドはカルシウムチャンネルに影響を及ぼすことが分かっています。ただし、エトサクシミドが作用するカルシウムチャンネルとは異なるカルシウムチャンネルに効果を及ぼすガバペンチンは、同じカルシウムチャンネル作用薬剤であるにもかかわらず、むしろ、欠神発作を悪化させます。
神経伝達物質
神経細胞の興奮性はグルタミン酸、γ-アミノ酪酸(gamma-amino butyric acid (GABA))といった神経間の情報伝達を担う神経伝達物質によっても規定されます。
グルタミン酸は味の素の原料にもなっている「うま味」のもとのアミノ酸です。このグルタミン酸がグルタミン酸受容体とよばれる神経細胞膜の受け皿にくっつくと、Ca ++ 、Na +、K + といった陽イオンの細胞膜での透過性が高まります。このため陰性を保っている(分極している) 神経細胞内は陽性に傾き、細胞膜内外の電位差がしぼみ (脱分極しやすくなり)、神経細胞の興奮性が高まります。イオンチャンネルが関与するグルタミン酸受容体はα-amino-3-hydroxyl-5-methyl-4-isoxazole-propionate (AMPA)、N-methyl-d-aspartate (NMDA)、カイニン酸(Kainate)といったアミノ酸にたいする親和性の違いにより3種類に分けられています。さらに、δ受容体というものもあります。
NMDA型受容体は記憶に関与していると考えられており、記銘力低下や見当識障害を主症状とする特異な慢性脳炎、抗 NMDA 受容体抗体陽性脳炎との関連が注目されています。しかし、てんかん発作との関連ではAMPA型受容体の方が重要です。というのは、中枢神経におけるグルタミン酸による興奮性シナプス伝達にはAMPA 型受容体が中心的役割を果たしているからです。実際、最近使われるようになったペランパネルという抗てんかん薬はグルタミン酸によるシナプス、AMPA型受容体の活性に関与し,抗てんかん作用を発揮することが分かっています。さらに、トピラマートもAMPA 型受容体を間接的に阻害する作用を有しています。
一方、γ-アミノ酪酸(GABA)はグルタミン酸のカルボキシル基がはずれたアミノ酸で、神経細胞接合部で神経細胞の興奮を抑えます。この興奮鎮静作用にはクロールイオンが関係しています。クロールイオン(Cl–)は陰イオンですが、クロールイオンが細胞内に入ると細胞内はさらに陰性に押しやられ(過分極)、神経細胞が興奮しにくくなります。神経細胞膜上のGABA受容体にGABAが結合すると Cl チャネルが活性化されてCl が細胞内に流入し神経細胞を過分極状態にして興奮を抑制するのです。このGABA受容体の遺伝子変異が全般てんかん熱性けいれんプラス、若年性ミオクロニーてんかんでみつかっています(GABRA1、G2)。GABA受容体に働いてクロールイオンの細胞膜での透過性を亢進させ、神経細胞の興奮性を抑制する抗てんかん薬としてはバルビツール酸系薬剤(フェノバルビタール,プリミドンなど)やベンゾジアゼピン系薬剤(クロナゼパム,ジアゼパム,クロバザム,ミダゾラムなど)があります。また、結節性硬化症に合併するてんかん性攣縮によく効くビガバトリンは神経と神経をつなぐ結合部(シナプス)のGABA分解酵素を阻害してGABA濃度を高め、抗てんかん作用を発揮していると考えられています。
抑制作用のある神経伝達物質としてはセロトニンもあります。人に安心感を与えたり、気持ちをリラックスさせたりする神経伝達物質で、うつ病薬の多くはセロトニンを活性化して人を活気づけます。セロトニンのこの作用は神経の興奮を抑制することによってもたらされますが、そのことが、てんかん発作の抑制にも結び付くことがあります。最近、フェンフルラミン(商品名:フィンテプラ)というドラベ症候群に特化した抗てんかん薬が使われるようになりましたが、この薬は神経端末にあるセロトニンを吐き出させ、さらには、神経端末のセロトニン受容体を勢いづかせる作用があります。このフェンフルラミンがなぜ抗てんかん作用を発揮するのか、じつは、正確なところはわかっていません。しかし、抑制性神経伝達物質であるセロトニンに対する作用が何らかの形で働いているのだろうと推定されています。
シナプス顆粒作動薬
その神経接合部(シナプス)を形成している神経線維末端にはさまざまな物質が存在していますが、その一つがシナプス小胞タンパク(Synaptic vesicle protein)です。接合部の出力側、シナプス前神経終末に存在する糖タンパク質で、その中のシナプス小胞タンパク2A(SV2A)はてんかん発作との関連が深いことが分かっています。SV2A遺伝子がないマウスが重度のけいれん発作を起こすことが確認されていますし、ヒトでもSV2A遺伝子変異によって難治性けいれん発作,不随意運動,発達遅滞がもたらされることが知られているのです。レベチラセタムはこのSV2Aに作用して抗てんかん作用を発揮します。最近、同じようにSV2Aに結合することにより、てんかんの発作抑制作用を発揮するブリーバラセタム(商品名ブリィビアクト)も発売になっています。
抗てんかん薬の作用機序と薬剤選択
| 薬剤名 (略語) | 商品名 | 成人常用量 (mg) 小児常用量(mg/kg) | 半減期(時間) 定状状態到達日数(日) | 血中濃度参考値(μg/ml) 蛋白結合率(%) | 主要作用部位 有効発作型 | 抗てんかん作用以外の薬効 |
| フェノバルビタール (PB) | フェノバール、ルミナール、 ワコビタール坐剤 ルピアール坐剤 | 30 – 200 2 – 10 | 70 – 130 14 – 21 | 15 – 40 45 – 60 | GABA、INa、ICa PS、GTC、Ton | |
| プリミドン (PRM) | マイソリン プリムロン | 750 – 2000 10 – 25 | 10-20 3 – 10 | 5 – 12 0 – 22 | GABA、INa、ICa PS、GTC、Ton | 本態性振戦 |
| フェニトイン (PHT) | アレビアチン、 ヒダントール ジフェニールヒダントイン | 200 – 300 3 – 10 | 7- 42 (少量)、20- (大量) 4 – 10 | 7 – 20 80 – 95 | Ina PS、GTC、Ton | |
| カルバマゼピン (CBZ) | テグレトール レキシン | 400 – 1200 5 – 25 | 10 – 26 3 – 7 | 4 – 12 65 – 85 | Ina、 PS、GTC、Ton | 三叉神経痛 双極性障害 |
| ゾニサミド (ZNM) | エクセグラン | 200 – 600 4 – 12 | 50 – 70 10 -15 | 10 – 40 45 – 50 | INa、ICa, GABA, ICAD PS、GTC、Ton。 Sp | |
| バルプロ酸 (VPA) | デパケン、エピレナート、 バレリン、ハイセレニン | 400 – 1200 15- 50 | 11 – 20 2 – 4 | 50 – 100 85 – 95 | GABA, ICa、INa Ab、My、PS、 GTC、 Sp | 偏頭痛 双極性障害 |
| バルプロ酸徐放剤 (VPA-R) | デパケン-R セレニカR | 400 – 1200 15- 40 | 12-26 5 – 7 | 50 – 100 85 – 95 | GABA, ICa、INa Ab、My、PS、 GTC、Sp | 偏頭痛 双極性障害 |
| ガバペンチン (GBP) | ガバペン | 600 – 2400 5 – 45 | 2 – 3 1 – 2 | 2 – 20 0 – 3 | ICa, GABA PS、GTC | むずむず脚症候群***** 疼痛、偏頭痛、不眠 |
| エトサクシミド(ESM) | ザロンチン エピレオプチマル | 450 – 1000 15 – 40 | 40 – 60 5 – 12 | 40 – 100 0 – 10 | ICa Ab、My | |
| ラモトリギン (LTG) | ラミクタール | 150-400(100-200*) 1-5(1-3*) | 15-35 (30-90*) 3-6 | 2 – 20 53 – 56 | INa → IGlu、ICa? PS、GTC、Ab | 双極性障害、離人性障害 片頭痛、末梢神経障害 |
| ゾニサミド (ZNS) | エクセグラン、ゾニサミド | 200 – 600 4 – 12 | 50 – 70 9 – 12 | 10 – 40 50 | INa、ICa、GABA、ICAD PS、Ab、Sp | 双極性障害、ミオクロニー性ジストニア、 慢性疼痛、片頭痛 |
| トピラマート (TPM) | トピナ | 200 -600 4- 10 | 20 – 30 4 – 5 | 5 – 20 13 – 17 | INa、AMPA, GABA、ICAD PS、GTC、Ton、Sp、 My、Ab | 偏頭痛、肥満 双極性障害 |
| レベチラセタム (LEV) | イーケプラ | 1000 – 3000 20 – 60 | 6 – 8 1 – 2 | 12 – 46 0 | SV2A、ICa、 PS, GTC, My | |
| ブリーバラセタム (BRV) | ブリィビアクト | 50 – 200 小児は適用外 | 8.84 – 9.34 1-2 | 未確定 17.5 | SV2A PS、GTC | |
| ルフィナミド (RFN) | イノベロン | ***体重別 | 8 – 12 2-4 | 5 – 30 30 | Ina Lennox-Gastaut 症候群 | 難治性強直発作重積状態 |
| スチリペントール (STP) | ディアコミット | 1000 – 2500 20 -50 | 4.5 – 13 1-2 | 4 – 22 99 | GABA Clonic, GTC## | |
| フェンフルラミン (FFA) | フィンテプラ | 0.2-0.7mg/kg | 18 4-5 | 未確定 44-50 | セロトニン↑ ドラベ症候群 | |
| ビガバトリン (VGB) | サブリル | 適用外 50 -150 | 5 – 8 (infant) 1 -2 | 0.8 – 36 0 | GABA Sp, PS | |
| ペランパネル (PER) | フィコンパ | 4-8(8 – 12 )****** 2mgから漸増 | 70 – 110 14ー21 | 0.05 – 0.4 96 | AMPA PS, GTC, (My#) | 不眠症 むずむず脚症候群、 皮質ミオクローヌス |
| ラコサミド (LCM) | ビムパット | 200 – 400 ****体重別 | 12 -13 2-4 | 5 – 10 15 | INa PS | むずむず脚症候群 神経原性疼痛 |
| ジアゼパム (DZP) | セルシン、ソナコン、 ホリゾン、ソナコン ダイアップ座剤 | 4 – 30 0.2 – 0.7 | 8 – 60 3-10 | 0.2 – 0.5 96 – 98 | GABAA-Cl Ab、My、PS、GTC、Ton、Sp | 神経症(不安、緊張、抑うつ) うつ病 筋緊張、疼痛 |
| ニトラゼパム (NZP) | ペンザリン ネルボン | 2 – 20 0.1 – 0,5 | 18 – 35 6 – 8 | 0.02 – 0.2 85 – 89 | GABAA-Cl Ab、My | 不眠 |
| クロナゼパム (NZP) | リボトリール ランドセン | 1 – 5 0.05 -0.2 | 20 – 60 5 – 10 | 0.02 – 0.08 86 | GABAA-Cl Ab、My、PS、GTC、Ton、Sp | |
| クロバザム (CLB) | マイスタン | 10 – 30 0.2 – 0.8 | 10 – 50 4 – 10 | 0.06 – 0.4 83 – 85 | GABAA-Cl Ab、My、PS、GTC、Ton、Sp | |
| スルチアム (ST) | オスポロット | 200 – 1000 5 – 10 | 2 – 10 < 5 | 1.5 – 20 30 – 45 | ICAD、INa My、Sp、PS、GTC | |
| アセタゾラミド (AZA) | ダイアモックス | 200 – 750 10 – 20 | 10 – 20 2 – 5 | 8 – 20 90 – 95 | ICAD Ab、My、PS、GTC、Ton、Sp | 頭蓋内圧亢進 |
| 臭化カリウム** (KBr) | 臭化カリウム | 300 – 1000 10 – 80 | 192 – 336 40 – 50 | 750 – 1250 0 | GABA、Synaps PS、GTC、GTC | |
| 表3 抗てんかん薬 *バルプロ酸併用時 **小児の難治てんかんにのみ認可 *** 4歳以上の小児 体重15.0〜30.0kg最初2日間は1日200mg、その後は2日ごとに1日用量として200mg以下ずつ漸増する。維持用量1日1000mg 体重30.1kg以上の場合 成人用量で。成人 最初2日間 400mg その後、2日ごとに400mg以下漸増。維持用量 重30.1〜50.0kgは1800mg、体重50.1〜70.0kgは1日2400mg、体重70.1kg以上3200mg。 **** 4 歳以上の小児にはラコサミドとして 1 日 2 mg/kgより投与を開始し、その後 1 週間以上の間隔を あけて 1 日用量として 2 mg/kgずつ増量し、維持用量を 体重30kg未満の小児には1日6 mg/kg、体重30kg以上 50kg未満の小児には1日4 mg/kgとする。症状により体重30kg 未満の小児には1 日12mg/kg、体重30kg以上50kg未満 の小児には1日8 mg/kgを超えない範囲で適宜増減。 ***** ガバペンチンのプロドラッグ、ガバペンチンエナカルビル(商品名レグナイト)が市販されている。服用後、体内でガバペンチンに変換される。 ******本剤の代謝を促進する抗てんかん薬と併用時 INa: 電位依存性ナトリウムチャンネル抑制、ICa:カルシウムチャンネル抑制、 IGlu:グルタミン酸受容体抑制、AMPA:AMPA型グルタミン酸受容体抑制、 GABA:ギャバ系賦活、GABAA-Cl:ギャバA受容体作動-クロライドチャンネル開放促進、ICAD:炭酸脱水酵素阻害(細胞内酸性度の低下による神経活動の低下作用?)、 SV2A:シナプス小胞タンパクAに結合し神経の過活動時のシナプス小胞放出を抑制 Synaps:シナプス伝導抑制 太字は主たる作用部位 PS:部分発作、GTC:強直間代発作、Ab:欠神発作、My:ミオクロニー発作、Sp:攣縮発作、Ton:強直発作 SMEI:重症乳児ミオクロニーてんかん(Dravet症候群) とくにCLB併用時 #:進行性ミオクローヌスてんかんに有効? ## 重症乳児ミオクロニーてんかんの間代発作とクロバザムおよびバルプロ酸服用時の強直間代発作に適応 Jacob S & Nair AB (2016), Bassel W et al (2019), 日本神経内科学会:てんかん診療ガイドライン2018を参考に改変 | ||||||
このように、抗てんかん薬は、てんかん発作発生に関与するイオンチャンネル、神経伝達物質、シナプス蛋白などにさまざまな形で影響を及ぼし、抗てんかん作用を発揮します。
こうした作用機序を知ると、どの薬がどの発作に効くか理論的に予測できるのではと期待したくなります。
たとえば、欠神発作がみられるマウスではカルシウムチャンネルの機能異常があることがわかっています。そして、人でも欠神発作のある人の一部でカルシウムチャンネルの異常が見つかっています。一方、欠神発作に有効なエトサクシミドは主としてカルシウムチャンネルに作用します。さらに、同じようにカルシウムチャンネルへの作用を有するバルプロ酸も欠神発作の特効薬として知られています。このように、カルシウムチャンネルによって、エトサクシミドやバルプロ酸の欠神発作への特効性がある程度説明可能です。このことはミオクロニー発作についてもいえます。
この調子で、すべての発作型やてんかん症候群にイオンチャネル異常や受容体異常がみつかり、そして、すべての抗てんかん薬の作用機序がはっきりすれば、合理的なてんかん薬物療法ができそうに思えます。
ところが、話はそれほど簡単ではありません。
表1でお分かりのように、抗てんかん薬のすべてが特定のイオンチャンネル、受容体だけに働くわけではありません。濃淡の差はありますが、複数の部位に働きかける抗てんかん薬が結構あります。そのうえ、カルシウムチャンネルに作用するガバペンチンが欠神発作に不向きだったりする「理論どおりにはいかない」例もあります。
さらに、同じナトリウムチャンネルであっても種類がいくつもあり、中枢神経内での作用、分布も異なることを考慮する必要があります。前にも言いましたように、ナトリウムチャンネルに主として作用するフェニトイン、カルバマゼピンがSCN1Aナトリウムチャンネル遺伝子に変異のあるDravet症候群(重症乳児ミオクロニーてんかん)に対して抗てんかん作用をあまり示さず、かえって、不随意運動などの不都合な症状をもたらすことがあります。SCN1A遺伝子変異で起こるもっと軽症の熱性けいれんプラス遺伝性てんかんでもナトリウムチャンネル阻害剤が発作を悪化させることが知られています。ところが、SCN8A、SCN2Aという異なったナトリウムチャンネル遺伝子の変異によって起こる同じDravet症候群ではフェニトインやカルバマゼピンがよく効くことが知られています。この違いが何によってもたらされるのか、まだ、よくわかっていません。
それに、特定のイオンチャンネル、受容体、シナプスにのみ異常があることが判明しているてんかん症候群や発作型は、今のところ、あまりありません。多くのてんかん発作、てんかん症候群では、特定のイオンチャンネル異常、受容体異常、シナプス異常、あるいは、それらを制御する遺伝子の変異との関連が、まだ、確定していません。このため、イオンチャンネル、受容体への薬理作用だけで抗てんかん薬を分類することはできませんし、発作型別、てんかん類型別の治療をおこなうこともできません。
このように、残念ながら、現時点では、てんかん発作の発生機序、抗てんかん薬の作用機序をもとにした整然とした、合理的な抗てんかん薬の選択は、まだ、できません。
しかし、一方で、発作型によって、効く、効かないがはっきりしている薬があることも事実です。たとえば、先ほど述べましたように、欠神発作に効く薬は限られています。現在日本で市販されているものでは、バルプロ酸、クロナゼパム、エトサクシミド、ラモトリギンが欠神発作の有効薬です。フェノバルビタールとかフェニトインといった薬は欠神発作には無効で、カルバマゼピンに至っては、逆に発作を増やすおそれさえあります。反対に、エトサクシミドは強直間代発作といった痙攣性発作への効果があまり期待できないことが知られています。
薬の効き目という点から欠神発作によく似ているのがミオクロニー発作です。やはり、バルプロ酸、クロナゼパムなどがよく効きます。ただ、エトサクシミドはミオクロニー発作に対して欠神発作ほどの効果は期待できません。フェノバルビタール、フェニトインも無効で、カルバマゼピンは欠神発作同様ミオクロニー発作を悪化させるおそれがあります。一方で、レベチラセタムがミオクロニー発作に効くことがあります。
さらに、テレビてんかん、テレビゲームてんかん、図形てんかんといった、視覚刺激によって誘発される発作にたいしては、全般発作でも部分発作でもバルプロ酸やクロナゼパムがよく効くことが知られています。
このように、発作型やてんかん類型によって得手不得手のある薬があります。
しかし、たとえば、同じ部分発作に対しては、かなりの種類の抗てんかん薬が効くことが知られています。ところが、その中で、ある抗てんかん薬がもう一つの抗てんかん薬に比べ絶対的に優れているという確実な証拠がありません(先に述べたように、ドラベ症候群で遺伝子変異の違いによってフェニトイン、カルバマゼピンのようなナトリウムブロッカーの効果が異なるといったようなまれな例外はありますが)。
このように、てんかんの薬物治療を抗てんかん薬の作用機序に応じて戦略的に行うことは現時点ではできません。ですから、てんかんの薬物治療には、かなり、「でたとこ勝負」的な側面が残っています。ほとんどのてんかんでは、実際に使ってみないと効くかどうかわからない、というのが本当のところです。
経験的治療戦略
しかし、だからといって、てんかんの薬物治療が、すべて「でたとこ勝負」というわけではありません。
上で申しましたように、抗てんかん薬には発作症状によってある程度、得手不得手があることがわかっています。そこで、それを基盤として、さらに、実際の治療経験も加味して、薬の使用方法を決定する試みがなされています。
薬の使用経験から薬を選択する場合、ランダム化臨床研究(Randomized Control Study : RCT )による結果を参考にするのがもっとも信頼性が高いとされています。たとえば、はじめて部分発作をおこした患者さんをカルバマゼピンで治療する群とフェニトインで治療する群とに無作為に(くじ引きなどで)分け、両群での発作消失率を比較検討するのです。そして、統計的にみてフェニトインがカルバマゼピンに比べ発作消失率が高く、副作用の程度が低ければ、フェニトインを部分発作に対しては第一に選ぶべきだと判断します。
しかし、この方法できちんとした結果を得るためには、発症年齢、性別、基礎疾患、合併症状などさまざまな要因を2群で同一にする必要があります。このため、膨大な数の患者さんの同意をえて、治験に参加していただく必要があります。しかも、通常使われている抗てんかん薬だけでも20種類以上あるわけで、そのすべての組み合わせについて比較検討するとなると、天文学的な数の患者さんの同意をえなくてはなりません。その上、ある薬が無効だった場合に次の薬はどれがいいかといった研究までこの方法でおこなおうとすると、気の遠くなるような数のランダム化臨床研究が必要になります。
とても、できるものではありません。
ところが、世界的にみても、抗てんかん薬治療にかんするランダム化臨床研究は、30種類以上の抗てんかん薬を考えると、ほんの一部にしか行われていません。その結果だけを基に、てんかんをもつすべての患者さんについて薬物療法をおこなうことは不可能です。
さらに、膨大な労力を費やしてランダム化臨床研究を行っても、二つの抗てんかん薬の効果に統計的差が認められないこともありえます。実際、部分発作に対するフェニトインとカルバマゼピンの間には差がないという結果が出ています。しかも、この結果は一人一人の患者さんにおける実態を反映していません。同じ部分発作であっても、ある患者さんにはフェニトインほうがよく効き、ある患者さんにはカルバマゼピンがよく効くということはめずらしくありません。同じ部分発作であっても、それをもたらす原因は千差万別ですから、ある意味、当然の結果といえるでしょう。いくら、年齢などの要因をそろえ、同質の群で比較しても、一人一人をみると、効き目が違って当たり前なのです。
このように、ランダム化臨床研究ですべての抗てんかん薬の効果を判定し順位を決めるのは不可能です。その上、その結果は個々の患者さんの実態を必ずしも反映していません。
そこで、最終的には、個々の担当医の経験に頼ることになります。
というと、非科学的な「職人芸」に頼っているように思われるかもしれません。たしかに、てんかんの薬物治療において、そういう面が残っていることは否定できません。
しかし、それだけではありません。
一人の医者の経験だけをもとにすると、たしかに、かなり偏った治療が行われてしまうかもしれません。しかし、多くのてんかん専門医の経験を数値化し、統計的に処理すれば、かなり信頼性の高い治療情報をえることができます。「職人芸」を科学的に検証し、誰でも使えるように、公式化するのです。この方式のいいところは、ランダム化臨床研究では答えがでない治療上のさまざまな疑問にたいしても、ある程度、答えをだしてくれることです。表4,5にお示ししたのは、そのような結果も加味して得られた日本とアメリカにおける発作型別の推奨抗てんかん薬の一覧です。ラモトリギンなどの比較的新しい薬が日本ではかなり遅れて認可されていなかったこともあって、ラモトリギン、トピラメート、オキシカルバゼピンが日本では第一選択薬に名前が挙がっていないなど,やや相違はみられますが、日米ともだいたい同じような薬剤を選択していることがわかります。
ただし、この薬剤選択を金科玉条のように信じ込むのも考えものです。繰り返しになりますが、一人一人の患者さんにおいては微妙なところで違いがあります。さらに、薬の副作用も、薬を選ぶ上で大きな要素になります。表に挙げた薬剤選択はあくまでも原則にすぎません。さらには、抗てんかん薬にも個性があります。狙いを定めた特定の発作に効くものから、全般発作にも部分発作にもまんべんなく効くものがあります(表6)。どちらがいいというわけではなく、これも患者さんの発作に合わせて使い分けることになります。このように、最終的には個々の患者さんに即して、試行錯誤によって薬を決めるしかないのは、先にお話したとおりです。
| 表4 日本神経学会 てんかん診療ガイドライン2018 https://www.neurology-jp.org/guidelinem/tenkan_2018.html |
| 発作型 | 第一選択薬 | 第二選択薬 | 慎重投与すべき薬剤 |
| 部分発作 | カルバマゼピン、ラモトリギン レベチラセタム、ゾニサミド トピラマート | フェニトイン、バルプロ酸、 クロバザム、ガバペンチン、 フェノバルビタール、 ペランパネル、ラコサミド | |
| 強直間代発作 間代発作 | バルプロ酸* | ラモトリギン、レベチラセタム トピラマート、ゾニサミド クロバザム、フェニトイン フェノバルビタール、ペランパネル | フェニトイン** |
| 欠神発作 | バルプロ酸*、エトサクシミド | ラモトリギン | カルバマゼピン フェニトイン、 ガバペンチン |
| ミオクロニー発作 | バルプロ酸*、クロナゼパム | レベチラセタム、トピラマート ピラセタム、クロバザム フェノバルビタール | カルバマゼピン フェニトイン、 ガバペンチン |
| 強直発作 脱力発作 | バルプロ酸* | ラモトリギン、トピラマート レベチラセタム | カルバマゼピン ガバペンチン |
* :妊娠可能年齢女性は除く
**:フェニトインは進行性ミオクローヌスてんかんに対して有効だが、生命予後を悪化させる
表5 日米推奨抗てんかん薬
| 特発全般てんかん | 症候性局在関連てんかん | 症候性全般てんかん | |||||||
| 強直間代発作 | ミオクロニー発作 | 欠神発作 | 二次性全般化発作 | 部分発作 | 強直間代発作 | ミオクロニー発作 | 欠神発作 | 強直発作 | |
| 日本の専門家 | バルプロ酸 | バルプロ酸 クロナゼパム | バルプロ酸 エトサクシミド | カルバマゼピン フェニトイン ゾニサミド バルプロ酸 | カルバマゼピン フェニトイン ゾニサミド | バルプロ酸 クロナゼパム クロバザム | バルプロ酸 クロナゼパム | バルプロ酸 クロナゼパム | バルプロ酸 クロナゼパム |
| 米国の専門家 | バルプロ酸 ラモトリギン | バルプロ酸 | バルプロ酸 エトサクシミド ラモトリギン | カルバマゼピン フェニトイン オキシカルバゼピン ラモトリギン バルプロ酸 | カルバマゼピン フェニトイン オキシカルバゼピン ラモトリギン | バルプロ酸 ラモトリギン トピラマート | バルプロ酸 ラモトリギン | バルプロ酸 ラモトリギン | バルプロ酸 ラモトリギン |
| 表6 抗てんかん薬の適応範囲 |
| 適応発作が狭い抗てんかん薬 | 適応発作が広い抗てんかん薬 |
| フェニトイン | バルプロ酸 |
| フェノバルビタール | ラモトリギン |
| カルバマゼピン | トピラマート |
| オキシカルバゼピン | ゾニサミド |
| ギャバペンチン | レベチラセタム |
| ラコサミド | クロナゼパム |
| ビガバトリン | ルフィナミド |
血中濃度参考値
一応、どの抗てんかん薬にも「通常」服用量というものが設定されています。この程度の量を服用すれば抗てんかん作用を発揮し、ひどい副作用もきたさない、という目安となる服用量です。そこで、てんかんの薬物療法を開始する際には、とりあえず、その「通常」量(小児の場合は体重当たり、もしくは、年齢別の「通常」量)を服薬していただくことになります。そして、一定期間(2~4週)たったのち、再度、血液検査をし、肝機能、電解質、血球数などの検査所見に異常値が出現していないか(隠れた副作用が発生していないか)チェックし、さらに、薬の血液内濃度、血中濃度を測定します。
抗てんかん薬の服用量が増えると、薬の脳内濃度も高くなります。それに伴い、発作がコントロールされる確率も高まります。しかし、その一方で、眠気、注意力の低下といった副作用がでやすくなります。そこで、抗てんかん薬の効果発現と副作用出現の目安として、薬の体内濃度を利用する試みが行われてきました。その場合、脳内の薬物濃度が測定できれば一番いいのですが、残念ながら、現在、これを簡便に行う方法はありません。正確に測定するには、脳を取り出してきて、すりつぶし、濃度を測るしかありません。もちろん、そんなことはできませんから、現在のところ、血中濃度で代用しています。脳内濃度と血中濃度は同一ではありませんが、ある程度、比例関係にあります。実際、多くの抗てんかん薬では、血中濃度によって抗てんかん薬の効果発現や副作用発現の可能性をある程度予測できることがわかっています。そして、各々の抗てんかん薬において、効果発現の可能性が高まる下限濃度から、副作用発現の可能性が高まる上限濃度までの「血中濃度参考値」が設定されています。
血中濃度参考値は便利な目安です。
治療を始めるときには、とりあえず、血中濃度参考値をめざして薬を増やしていくことができます。最低、血中濃度参考値下限は越えるよう目標を設定するのです。そして、もし、血中濃度参考値下限を越えるまで増やしても発作が続くようなら、副作用に注意しながら、徐々に薬を増量します。その場合でも血中濃度参考値上限以下であれば、副作用もでにくいだろうと見越して、比較的安心して薬を増やしていくことができます。
ただし、血中濃度参考値というのはどの血中濃度で発作が止まり、どの血中濃度で副作用が出現したかを多数の患者さんにおいて調べ、統計的に処理して決められた値です。あくまでも確率論的な濃度枠ですから、血中濃度が「血中濃度参考値」下限を超えていなければどの患者さんでも発作が止まらないというわけではありません。患者さんによっては血中濃度参考値下限以下でも発作再発を抑制できることがあります。もし、発作が止まれば「血中濃度参考値」以下の血中濃度でその時の量の薬をのんでいただきます。ただ、確率からいうと「血中濃度参考値」以下では発作抑制率が低くなってしまいますから、とくに薬の飲み始めなどは、安全を見越し、血中濃度が血中濃度参考値下限を越えるよう、服薬量を調節することがあります。発作が年に数回という方ですと、発作が本当に止まっているかなかなか判断できないからです。
うまく発作がコントロールされ、しかも、副作用を疑わせる症状や検査所見がみられなければ、数年にわたって、その量を飲み続けていただくことになります。お子さんの場合、成長とともに体重が増え、同じ服薬量では血中濃度が徐々に下がって、ついには血中濃度下限を下回ってしまうことがありえます。しかし、発作が再発しなければ、たいてい、服薬量は増やしません。発作が再発していないのであれば、血中濃度参考値下限以下でも、その「血中濃度参考値下限以下の血中濃度」がその子の「血中濃度参考値下限」を「上回って」いると推定されるからです。小児てんかんの場合、成長とともに「てんかん域値」が上昇し、てんかん発作が起こりにくくなる可能性もあります。ですから、服薬量を増量せず「自然減量」にまかせることがあります。
| メモ2 てんかんにおける治療薬モニタリングの要点 Jacob S & Nair AB (2016) 1.てんかん発作は散発的に起きるため、通常、抗てんかん薬による薬物療法は経験に頼った予防的なものにならざるをえない。 2.治療薬モニタリングは発作を抑制できる最小血中濃度、副作用が生じる最大血中濃度を確認し、患者一人一人の最適血清(血漿)濃度範囲を確定する。 3.治療薬モニタリングは最適な薬物治療と疾患管理を可能にする決定的で効果的な手段である |
問題は、血中濃度が「血中濃度参考値」上限値近くにまで達しているにもかかわらず発作が再発する場合です。
再発の多くは服薬を開始して間もなく起きます。こうした場合、「血中濃度参考値」上限値近くにありながら発作が止められなかったというので、その薬をすぐにあきらめてしまいがちです。しかし、ここで我慢が肝心です。副作用がでないか注意しながら、少しずつ増量するのです。しつこいようですが、血中濃度参考値というのは統計的概念にすぎません。血中濃度参考値上限というのは、ある一定の割合の人間において副作用が出現する値にすぎません。全員に副作用が出現する値ではありません。少しぐらい血中濃度参考値を超えても副作用が出現しない人がいます。
抗てんかん薬の数は限られます。血中濃度参考値の上限に達しても発作をコントロールされないからといって、抗てんかん薬をそれ以上増量するのをあきらめるのは、もったいないことです。抗てんかん薬の効果を限界まで確認するため、副作用がなければ「血中濃度参考値」上限を超えるまで薬を増量してみるのも一法です。それによって、はじめて、その薬の有効性をきちんと評価できるのです。
もちろん、増量していけばどこかの時点で許容しがたい副作用が出現します。結局、そのような副作用が出現し始めた濃度がその人の「血中濃度参考値」上限ということになります。
逆に、「血中濃度参考値」上限に達していないのにひどい副作用がでてしまう方もみえます。耐え難い副作用が出現してきているのに「血中濃度参考値」範囲内だからといって薬を増量することも、もちろん、すべきではありません。そこが、その人の「血中濃度参考値」上限なのです。
このように、抗てんかん薬の服用量は、「血中濃度参考値」を参考にしながらも個々の患者さんの薬に対する反応を見極めつつ調整し、その患者さんの「血中濃度参考値」を確定します。一般的な「血中濃度参考値」は個々の患者さんにとってあくまでも指標にすぎません。
ついでながら、すべての抗てんかん薬で血中濃度参考値が設定できるわけではない、ということも断っておくべきでしょう。理由の一つは、一応、参考域が設定はされているのですが、幅が広すぎて、あまり意味をもたない薬があることです。典型的なのがジアゼパム、ニトラゼパムのようなベンゾジアゼピン系の薬です。ベンゾジアゼピンは神経細胞のベンゾジアゼピン受容体に働くのですが、この受容体の数が人によって大幅に異なるために血中濃度参考値も大きくならざるをえないのです。しかし、では、こうした薬で血中濃度を測っても仕方がないのかというと、そんなことはありません。ひとりひとりの患者さんには「血中濃度参考値」があって、どの濃度から薬が効き始め、どの濃度から副作用が出始めるかということは経時的に血中濃度を測定していればだいたい分かってきます。その「血中濃度参考値」はこまめに血中濃度を測らなければ確定できません。
ベンゾジアゼピン以外にも、さまざまな理由から血中濃度参考値を薬の増減に役立てられない薬があります。たとえば、比較的最近使われるようになった抗てんかん薬、レベチラセタム、スチリペントール、ビガバトリン、ラコサミドなどは、十分なデータの集積もないこともあって信頼できる血中濃度参考値が確定しているとは言えません。
その一方で、血中濃度測定が必須といってもいい薬があります。その代表がフェニトインです。フェニトインは血中濃度参考値の10-20μg/mlあたりで、薬を少し増量しただけで(あるいは、他の薬によって代謝速度が鈍ると)あっという間に血中濃度が上昇し、すぐに、副作用域に達してしまいます。ですから、用心して、血中濃度を細かくモニターする必要があります。もうひとつ、ラモトリギンは他の薬によって代謝動態が大きく変化し、血中濃度が変化しますから、これも、血中濃度を念入りに測定することが望まれます。
さらに、フェノバルビタール、バルプロ酸、カルバマゼピン、ペランパネル、ルフィナミドも血中濃度が治療戦略を立てる上で活躍します。とくに、カルバマゼピンは自己酵素誘導といって自身が自分の代謝を活発化させる機能があるため、とくに飲み始めなどは同じ量を飲んでいても血中濃度が下がっていってしまいますので、最初のうちは頻回に血中濃度を測定する必要があります。
また、エトサクシミド、ゾニサミド、トピラマート、プリミドンなども血中濃度の測定が治療計画を立てる上である程度役立ちます。
以上のように、薬の濃度を経時的に測定し、どこで発作がコントロールできて、どこで副作用が出始めるのかを確認し、その値を参考に治療戦略を立てるやり方を治療薬モニタリング(Therapeutic Drug Monitoring :TDM)といいます。抗がん剤や抗不整脈薬などさまざまな治療薬で行われていますが、てんかんの薬物療法においても重要視されてきた診療手段です。
しかし、以上述べてきたことで分かるように、血中濃度だけをみててんかん診療を行うと、知らぬ間に間違った方向に行ってしまう恐れもあります。事実、血中濃度を漫然と測っても、副作用を減らすことも、薬の有効度を上げることもできないという意見もあるぐらいです。発作が落ち着いて濃度を確認したい時、薬物中毒が疑われた時、怠薬が疑われた時、あるいは、小児、高齢者、妊娠中などで血中濃度が公式通りの値にはならず、変動する可能性がある時だけ測ればいいのだというのです。そこまで言い切っていいのかどうかは議論のあるところですが、たしかに、惰性で漫然と定期的に濃度を測るのも考えものです。
定常状態
薬を服用すると胃や腸から薬が吸収され、徐々に、体内の薬の濃度が上昇します。しかし、身体は薬を「毒」と認識しますから薬を追い出そうとします。こうして、薬の血中濃度は数十分から数時間かけて最高値に達したあと徐々に低下、最終的にゼロになります。しかし、濃度がゼロになってしまう前に再び薬を服用すると、一回目以上に血中濃度が上がり、その後、再び下がっていきます。このようにして、一定間隔で繰り返し何度も薬を飲むと、変動しながらも徐々に血中濃度が上がっていきます (図5)。
しかし、永遠に上がり続けるわけではありません。しばらくたつと薬の体内への吸収と体外への排泄が平衡状態に達し、薬の血中濃度の最低値と最高値が定まり、その一定の枠内で濃度が推移するようになります。これを定常状態といいます(図5)。抗てんかん薬のように薬を長期にわたって服用する場合、体の中ではこの定常状態が保たれています。定常状態に達するまでの期間は薬の半減期の約5倍とされています。薬の半減期というのは、薬を最初に服用したとき、薬の血中濃度が最高値に達してから徐々に下がっていって、その半分の濃度になるまでの時間をいいます。
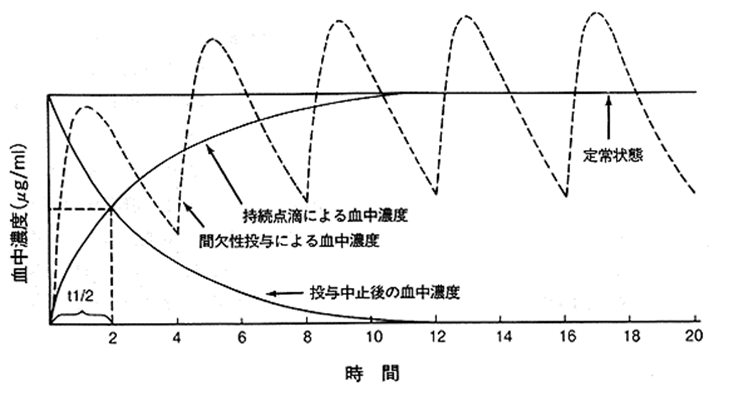
図5 薬をくり返し飲んだ場合の血中濃度の変動(点線)
半減期の約5倍たった時点で、薬の濃度持続点滴した場合と同様の定常状態の濃度で上下するようになる。
t1/2:半減期。
(ボーター著 渡辺一功監訳。てんかん診療第3版 医学書院1996)
たとえば、フェノバルビタールの半減期は72時間ぐらいですから、定常状態に達するまでには15日間ぐらい要します。ですから、発作が止まらないからとフェノバルビタールの量を増やしても、定常状態の濃度に移行するまでには2週間以上かかります。ですから、増量したことによる効果を判定するには、最低2週間は必要ということになります。もし、それが待てないということであれば、大量のフェノバルビタールを短期間服用していただき、一時的に血中濃度を吊り上げるということもあります(ただし、いっぺんに濃度が上昇するために、眠気などの副作用は避けがたいですが)。
一方、バルプロ酸の半減期は2-4時間とフェノバルビタールに比べかなり短く、このため、数日で定常状態に達します。ただし、これは「なまの」バルプロ酸製剤の話です。胃で溶けないように工夫が施された腸溶剤(徐放製剤ともいい、その特性によって、1日1-2回の服用によっても血中濃度の振れ幅が減り、副作用が出にくく、発作が起こりにくくなることが期待されます。商品としてはデパケンR、セレニカRなどがあります)では、半減期は5-7時間と2倍近く延長し、したがって、定常状態に達するのにも時間を要することになります。
薬を飲み始めたとき、そして、薬の量を変更したときは、以上のことを念頭において下さい。飲み始めてすぐに薬が効くわけではありません。そして、薬の量を変更しても、その効果が現れるまでには最低、数日要します。
ちなみに、定常状態の血中濃度は、定常状態といいながら実際には波打っているので、この波のどこで血中濃度を測定すればいいのかが問題となります。一般的には一番安定している底の部分で判断するのが良いとされていますが、そのためには薬を服用する直前に採血する必要があります。たとえば、1日2回朝夕服用していれば、朝起きてすぐ、7時前、夕方は19時前あたりとなります。しかし、一般診療の場でこの時間に採血するのはかなり無理があります。このため、薬服用の2時間後と決めて採血することもあります。波の底の部分ではありませんが、相対値として経過を見るのであればこれで代用できます。
薬剤耐性 tolerance
当初、有効と思われた抗てんかん薬がだんだん効かなくなり、どれだけ量を増やしても発作を押さえられなくなることがあります。これを、薬剤耐性といいます。クロナゼパム、ニトラゼパムなどのベンゾジアセピン系薬剤に顕著にみられる現象です。しかし、ベンゾジアセピンほどはっきりしなくても、薬剤耐性は他の抗てんかん薬にもみられます。とくに、難治てんかんの場合、一旦は素晴らしくよく効いたのに、だんだん発作がぶり返すようになることは、どの薬においても経験することです。
ただし、ある抗てんかん薬で数年発作がおさまっていたのに、その後、再発するといったケースは、薬剤耐性というよりも、以前述べたように、てんかん原性が「成長」した結果と推測される場合もあります(図3、7)。内側側頭葉てんかん、皮質形成異常などによる難治てんかんによく観察される現象です。この場合、一旦再発すると、残念ながら、いかなる抗てんかん薬も効かなくなることがほとんどで、外科治療を考慮する必要があります。
薬剤耐性は悪いことばかりではありません。抗てんかん薬服用によって起こる眠気、ふらつきなどの副作用にたいする「耐性」も生じるからです。これも、ベンゾジアセピン系薬剤でよくみられる現象で、しかも、てんかん発作に対する耐性よりも早期に出現します。ですから、服用開始後しばらく眠気、ふらつきがみられても、そのうちみられなくなり、抗てんかん作用はしばらく安泰となることが期待できます。ただし、眠気、ふらつきは、やはり、問題ですから、普通、そうした副作用がでないぐらいの少量から開始して、増量することがほとんどです。そして、その後も血中濃度、発作状況をみて、量を調整することになります。
カルバマゼピンも副作用に対する「耐性」がでやすいことで有名です。飲み始めたときにはひどい眠気を生じたのに、半年後には、同じ量を服用していても何ら眠気がみられないということがカルバマゼピンではよくみられます。ただし、この薬の「副作用耐性」の機序はちょっと複雑です。カルバマゼピンには、先程述べたように、酵素自己誘導といって、みずからの生体内における代謝を活発化させる作用があります。このため、薬を飲み続けると体内での分解速度が加速し、徐々に血中濃度が低下します。当然、副作用は時がたつにつれ、でにくくなります。こうして、あたかも副作用に対する「耐性」が生じたかのようにみえることがカルバマゼピンにはあります。酵素自己誘導は1カ月ぐらいでおさまるとされていますが、服用量によってはもっと長く続くこともあり、数ヶ月、血中濃度がゆっくりと下がっていくこともあります。ですから、それまでは、血中濃度測定を頻回に行い、薬の濃度がある程度保たれているかチェックする必要があります。
耐性と並行して、薬物依存性がでてくることもありますので注意が必要です。体が薬に慣れ、ついには、薬を飲み続けないと変調をきたしてしまうようになるのです。これも、ベンゾジアセピン系薬剤で顕著です。抗てんかん薬は定期的に飲む薬ですから、飲んでいる限りは「薬物依存」もあまり問題ではありません。しかし、薬を減量中止するときには、注意しなければいけません。禁酒などと同様、突然、抗てんかん薬をやめてしまうと、ふらつき、譫妄をはじめとしてさまざまな身体症状、精神症状がみられることがあるのです。これは、離脱現象とは区別して考えるべきものです。しかし、離脱現象同様、症状を回避するためには、ゆっくり減量中止することが肝心です。
単剤療法からはじめる
てんかんの薬物治療は、一つの薬を服用することから始まります。そして、目立った副作用がみられない量で発作が再発しなければ、その薬による治療は成功ということになります。しかし、発作が再発した場合、血中濃度に注意しながら、少しずつ、薬の量を増やしていきます。そして、副作用がみられるぐらい薬を増量しても、まだ、発作が起こるようであれば、その薬を無効と判断します。その薬をあきらめ、次の薬を試すことになります。
新しい薬を試す場合、原則として、無効と判断した前の薬は減量、中止します。
こうやって一剤ずつ薬の効果を確かめていくのです。
しかし、3剤ぐらい試しても、思わしい結果が得られないときには、これはと思う薬を2剤、3剤併用することもあります。
一つの薬のみで治療する場合を単剤療法、複数の薬を併用する治療法を多剤併用療法といいます。
多剤併用療法によって、やっと発作がコントロールされるということもないわけではないので、難治てんかんに対しては、やってみる価値のある治療法かもしれません。実際、てんかんによっては、2種類以上のてんかん発作がみられていることもありますから(たとえば、レノックス・ガストー症候群にみられる強直発作と非定型欠神の合併)、2種類以上の抗てんかん薬を使うことが少なくありません。さらに、ある薬が少しは効いたけれど、完全には発作を止めきれず、かといって、ひどい副作用もないといった場合、その薬を切るのは惜しいので残しておいて、もう一つ薬を加えようということもありえます。その薬と他の薬の相乗作用を期待するわけです。
しかし、複数の薬を使うと、どの薬が効いているのかだんだんわからなくなってしまいます。副作用についても同じで、副作用症状がどの薬のせいなのか特定できなくなってしまいます。
そのうえ、多くの抗てんかん薬が互いに影響し合って、血液濃度を上げたり下げたりする可能性もあります。たとえば、バルプロ酸はフェノバルビタールの血液濃度を上げます。ですから、バルプロ酸を増量して発作の回数が減ったとしても、この時、フェノバルビタールも服用していれば、単純にバルプロ酸が効いたとは必ずしもいえません。バルプロ酸の増量にともなって血中濃度が上昇したフェノバルビタールの効果かもしれないからです(こういうこともあって、二つの薬の相乗作用を判定するのはきわめて困難です。間違いなくヒトで相乗作用があると確認されているのはバルプロ酸とラモトリギンの組み合わせだけです)。
2種類の薬だけでもこんな風ですから、3種類、4種類の薬を使うとなると、ほとんど「アクロバット的薬物療法」となってしまいます。どの薬で発作が止まり、どの薬で副作用がでているのかわからなくなってしまうのです。合理的な薬物療法がきわめて困難になります。実際、てんかんの専門病院に紹介されてくる難治てんかんの患者さんにたいし、まず、最初に行われるのが、薬の整理です。それによって発作が止まらないまでも、副作用が低減されることは少なくありません。
こうしたことから、てんかんの薬物治療は、2-3種類の抗てんかん薬を使って、まずは、単剤治療で行います。それでも奏効しなければ多剤療法を行いますが、その場合でも、同時に使う薬は何とかして2剤にとどめておくのが賢明です。3種類以上の抗てんかん薬を同時に使うこともないわけではありませんが、一時的なものにとどめておいて、つねに、薬の種類を減らすよう心掛けることが肝心です。
薬剤抵抗性てんかんへの対応
しかし、そのように複数の薬を服用してもてんかん発作がコントロールされないことがあります。これを薬剤抵抗性てんかんと呼ぶようになったことは以前述べました。そして、薬剤抵抗性てんかんのうち、外科治療、食事療法によっても改善できず(改善が望めず)、生活に支障がある発作が継続的に月に数回以上起きるてんかんを難治てんかんといいます。
発作が長期にわたって頻回に繰り返しみられると、就学、就労に多大な影響を及ぼし、家庭生活も社会生活も制限されることがあります。お子さんですと、発達への影響も懸念されます。精神的な影響も計り知れず、発作のせいで引っ込み思案になって、人とのつきあいがうまくいかなくなることもあります。ですから、できうる限り発作は止めなくてはなりません。
しかし、残念ながら、薬だけでは対応できない方が2~3割いらっしゃいます。
こうした薬剤抵抗性てんかんに対し、焦りは禁物です。薬剤抵抗性てんかんらしいと判断されたら、一度、立ち止まって、ゆっくり考え直すことが肝心です。
診断も含め再検討します。
まず、止まらない発作が本当にてんかん発作なのか、念を入れて、もう一度確認し直します。改めて、発作症状を詳しくお聞きし、てんかん発作と考えておかしくないか検討します。これはとても大切な作業です。てんかんセンターなどの専門施設に紹介されてくる「難治てんかん」のうち数10%が、実は、てんかん発作を有していないという報告がなされているからです。てんかん発作でないものを抗てんかん薬で止めようとして、薬剤抵抗性てんかんと誤診していることが少なくないというのです。ですから、「薬剤抵抗性てんかん患者」さんでは、今まで治療してきた発作が本当にてんかん発作なのか、まず、腰を据えて検討し直す必要があります。これを確認する一番確実な方法は、ビデオ脳波同時記録によって「発作」に一致して、脳波上、てんかん発作を示唆する律動波がみられることを確認することです。しかし、これは、どこででもうまくできる検査ではありません。ビデオ脳波同時記録に手慣れた臨床検査技師などの医療スタッフが充実しているてんかんの専門病院に受診していただく必要もでてきます。
ただし、そうした専門機関でも、ビデオ脳波同時記録によって明確な結論が出せるという保証はありません。しかし、少なくとも、違った目でもう一度発作の正体を再検討するいい機会にはなります。いわゆるセカンドオピニオンを聞くことができるわけです。このセカンドオピニオンによって、てんかん発作の有無についてより正確な情報が得られる可能性があります。そして、やはり、紛れもないてんかん発作ということになれば、いかなるてんかん発作が起きていて、何が原因かを再検討し、それによって、薬物療法の新たな戦略を打ち立てることができるかもしれません。もし、薬物治療に限界があるということになれば、外科治療、食事療法の可否についても検討することになります。
外科治療
薬でコントロールできない薬物治療抵抗性難治てんかんに対し、薬物治療の次に考慮されるのが外科治療です。
てんかんの外科治療を検討する場合も、まず、原点に戻って、頻回にみられている発作が本当にてんかん発作かどうかを、もう一度確認します。病歴、画像、血液検査を改めて見直し、(ときとして、それまで飲んでいた抗てんかん薬を減量してでも)なんとかしてビデオ脳波同時記録で「発作」を捉えようと試みます。
間違いなくてんかん発作であることが確認されると、次に、そのてんかん発作がどのような発作型であり、てんかんとしてどこに位置づけられるのか、もう一度、検討します。
| メモ3 ILAEによる薬剤治療抵抗性てんかんの定義 Definition of drug resistant epilepsy : consensus proposal by the ad hoc Task Force of the ILAE Commission on Therapeutic Strategies (2010). そのてんかんに対し適切とされる抗てんかん薬を単剤あるいは多剤併用で副作用がない範囲の十分な血中濃度で2剤試みても一定期間(一年以上もしくは治療前の最長発作間隔期間の3倍以上のいずれか)発作を抑制できないてんかん。 |
また、外科治療によってどのような脱落症状が出現するかも、正確に予測する必要があります。さらに、手術では予期せぬ合併症も起こり得ます。外科治療に当たっては、それらすべての情報を患者さんと患者さんの家族にお伝えし、納得していただけるまで、十分に話し合います。そして、手術のあとも、発作のみならず、心理社会的側面も含め患者さんのすべての面を注意深く見守っていく必要があります。
このため、てんかん外科治療はてんかんの診断、発作のビデオ脳波同時記録、神経心理学的評価など、てんかんについての全方位的評価ができ、てんかんに関連するさまざまな分野の専門家がそろっている病院(もしくは複数の病院群)で行う必要があります。てんかん外科治療は手術を行うだけという単純な治療ではありません。てんかん臨床に精通した医師、ソーシャルワーカー、臨床心理士、作業・理学療法士、看護師などからなる「てんかん外科医療チーム」によってあらゆる角度から検討して、総合的判断に基づいて行われる治療です。
外科治療を行う際、まず、問題となるのが、どの時点で抗てんかん薬による治療に見切りをつけるかです。てんかん外科治療が盛んに行われるようになる1980年代までは、抗てんかん薬を4剤は使ってみて、それでダメなら外科治療を考えよう、という意見が大勢を占めていました。5剤目あたりから有効率がガクンと下がるというデータを基にした意見でした。しかし、てんかん外科にたずさわる医師たちは、患者さんの生活の質を考えるならもっと早く見切りをつけててんかん外科を考えてもらったほうがいいと感じていました。そして、21世に入ると、その実感を裏付ける研究成果がいくつも発表されました。以前述べましたように、少なくとも思春期以降であれば、発作が抑制されるのはほとんどが2剤目までで3剤目以降で発作が抑制される可能性が少ないことが分かってきたのです。じつはそれまでの「5剤目説」は後から振り返って評価する後方視的研究から導き出されたものでした。この「振り返り」研究では対象とすべき集団を漏れなく評価しているとはいません。たとえば、発作が簡単に止まってしまって、薬を中止した例は振り返りの時点で病院に来なくなっていて、調査対象から抜け落ちていることが少なくありません。このため、全体像をきちんと評価できていなかったのです。21世に入ってから発表されたデータはそれとは異なり、てんかんと診断した人を漏れなく登録し、前向きに、辛抱強く経過観察した、前方視的研究によるものでした。たとえば、ある前方視的研究ではてんかん発作が一剤目に50%、2剤目に11%で発作が抑制されるものの、それ以降、3番目から9番目の薬で抑制されるのは、併用例も含めても5%にすぎないという結果がでています。こうした研究によって、抗てんかん薬2剤というのが一つの目安になりました。
このような検討がなされるようになったのには他にも理由があります。
昔と違って、使える抗てんかん薬がうなぎ登りに増え、30種類以上に達する国もでてきたのです。そのすべての抗てんかん薬を試していたら膨大な時間がかかり、下手をすると患者さんの一生が薬の試行錯誤で終わってしまいます。そこで、薬を試す期間についても検討が加えられ、2年以上発作が抑制されなければ、その後、発作が止まる確率は極端に下がることがデータで示されました。
こうした結果を承けて、国際抗てんかん連盟ILAEはメモ3に示したような薬剤抵抗性てんかんの定義を2010年に定めています。この定義によって、抗てんかん薬を2剤使っても発作が止まらなければ、遅くとも2年以内に一度はてんかんの基幹病院に受診して、てんかん外科治療の可能性を探るべき、というコンセンサスが世界中の専門家の間で広がりました(ただし、以上の薬剤抵抗性てんかんの定義は小児のてんかんにはそのまま当てはめることはできません。小児では、3剤以降も結構発作が止まる例がありますし、2年以上すぎてから発作が止まる例も少なからずあるからです。これには脳の成熟が関係しているものと考えられています(図6))。

| 図6 小児期発症症候性局在関連てんかんの抗てんかん薬による推定発作消失率 15歳未満で発症し5年以上経過観察した症候性局在関連てんかん169例における薬剤治療の有効率(発作が一年以上消失する推定確率)と投与薬剤数との関係(左表)と経時的変化(右図、棒グラフ)を示す。有効率は1剤目が最高で、2剤目以降有効率は徐々に低下、5剤目からはかなり低下することが分かる。また、1年以内に抗てんかん薬で発作が止まらなければ、その後、発作がコントロールされる確率は2.5%に低下、5年を過ぎれば1%以下となる。これに対し、きちんと適応を選べば、外科治療によって30-70%で発作が消失する可能性がある(ただし、薬剤治療に関するこのデータは後追い調査(後方視的調査)の結果である。また、小児のデータであり、成長の因子が加わってくるので、成人てんかんのデータとは異なっている)。 |
といっても、難治てんかんであればすべて外科治療の対象となるわけではありません。どのような術式を含めるかによっても異なりますが、外科治療の適応は薬剤抵抗性てんかんの半数にも満たないとされています。しかし、逆に、適応対象を厳密に選べば、外科治療で最低でも30%以上の発作コントロールがえられます(ただし、この30%という数値は、あとで述べる切除外科治療の有効率で、遮断外科治療の結果は含まれていません)。この数字は抗てんかん薬によって期待される発作抑制率を大幅に上回ります。ですから、だらだらと薬剤治療を試すよりも、適応があれば、まずは、外科治療を考えるべきということになります。適応を選べば外科治療でかなりの確率で発作が止まる可能性がありますし、止まらないまでも、発作が激減すれば生活の質が向上し、死亡率までも低下します。
てんかん外科治療の歩み
しかし、そうはいっても「脳にメスを入れる」のはできることなら避けたいところでしょう。躊躇される患者さんや家族の方は少なくありません。飲むことで済む薬でなんとかならないかとおっしゃいます。事実、「脳にメスを入れる」ことによって機能障害がでるおそれがまったくゼロとはいえません。薬物治療と同じように、外科治療においても、最終目標は、発作消失によって「普通の生活」に戻ることができるよう、生活環境を整えることです。発作は止まったものの、記憶障害、言語障害といった脱落症状がでて、まともな生活ができなくなっては元も子もありません。そこで、手術前に、脳の切除による機能障害を最小限におさえるように(理想的には、全くないように)、細心の注意が払われます。そして、いかなる脱落症状も出現しないよう、あらゆる可能性を想定して術式が決定されます。残念ながら、機能脱落や副反応をまったくゼロにはできませんが、医療技術の進歩によって、生活の質をさほど損なわず、てんかん焦点を取り去ることができるようになってきています(ただし、薬物治療でもいいましたが、すこしぐらいの術後機能障害(副作用)がでても、発作を消失もしくは軽減することが優先される場合もまれにあります。その場合、「やむを得ない最終手段(the last resort)」として患者さん(もしくは保護者の方)の十分な了解を得て術後機能障害出現を覚悟の上で手術に踏み切ります)。
しかし、そういわれても、この恐ろしげな手法を納得できない方もみえるでしょう。
そこで、「脳にメスを入れる」てんかん外科治療の歴史をここで少し振り返ってみたいと思います。脳に切り込む「メス」がどのように誕生し、成長してきたかを知っていただければ、「敵」の正体がみえてきて、少しは不安を払拭していただけるかもしれません。
てんかん外科治療は、1886年5月25日にイギリスの外科医ホースリーが頭部外傷後の22歳のてんかん男性に行った手術が始まりということになっています。それ以前にも戦争などで頭部に外傷を負った兵士の脳の傷跡を修復しててんかん発作がおさまったといった類いの報告はいろいろあったようです。しかし、ホースリーの手術の場合、近代てんかん学の父と呼ばれるジャクソンの脳機能局在論と神経生理学者フェリエがおこなった動物における大脳皮質電気刺激実験のデータに基づいて、発作症状、発作間欠期の症状から除去すべき脳の部位を推定したという点が、それまでの手術と違っていました(もっとも、実際に行われた手術は瘢痕化した血管とその周囲脳組織の除去にすぎませんでしたが)。実際、ジャクソンは手術がなされた症例の主治医で、ホースリーの手術にフェリエとともに立ち会っています。頭部外傷における脳の瘢痕組織や脳腫瘍のように、目に見える病変に対応する手術と違い、目に見える脳の器質的病変はなくても脳の機能を念頭において行う手術を機能的脳神経外科手術といいますが、ホースリーの手術はその先駆けとなるものでした。そして、狙い通り、手術によって発作はかなり減ったといわれています(同じような狙いの機能的脳神経外科手術はホースリーの手術以前にも行われていたようです。しかし、ジャクソンの名声に包まれた有名病院で行われた手術だったため、今に至るまで、ホースリーにてんかん外科創始者の名誉が授けられているのだともいわれてはいますが)。
しかし、その後、しばらく、てんかんの外科治療の歩みは遅々たるものでした。脳が頭蓋骨に包まれているため、その病変を外からうかがい知ることがなかなかできなかったからです。何らかの病変があるかどうかも分からないのに、てんかん発作症状だけを頼りとして脳の一部を切りとりにいくのは、いくら発作症状という指標があるとは言え、そう易々とはできません。細々と行われた手術例は、手榴弾による頭蓋損傷、脳腫瘍など、何らかの器質性脳障害が明らかな例がほとんどでした。有名なペンフィールドの手術症例でもそうした例が少なくなかったようです。病変の存在が少なくとも手術を行うきっかけとしては必要で、そうでもなければ、てんかん発作があるというだけではなかなか手は出せませんでした。
すでに、レントゲンは実用化されていて、頭をレントゲン撮影することは可能でした。しかし、通常の単純レントゲン撮影で見ることができるのは頭蓋骨だけです。脳はみえません。1919年にアメリカのダンディーが脳室を可視化する気脳写を開発し、1934年にポルトガルのモニスが脳血管撮影を考案し、頭蓋骨の内部をわずかに窺い知ることができるようになりました。しかし、いずれの画像技術も脳そのものを映しだすわけではありません。脳の影がみえるだけです。影だけを頼りにそう簡単には脳を切り取りにいくわけにはいきません。
それに、病変がある程度分かっていても、てんかん外科治療の結果はあまり思わしくありませんでした。たとえば、1936年から1942年にかけて、主として、発作症状と病変を参考にしてアメリカのアイオワ州で行われたてんかん外科治療(ほとんどが現在でも有効率が低い新皮質切除)の結果は、5年以上の発作消失が11%にすぎず、53%は改善なし、12%は死亡(6%は術中)でした(ちなみに、日本ではホースリー手術の16年後、伊藤隼三(京都大学)が1902年に全般てんかん39例に側頭下減圧術を行ったと報告したのがてんかん外科の始まりとされています。1952年には渡邉一郎が146例の遠隔成績を報告しており、治癒19%、軽快29%、不変25%、増悪13%、死亡14%でした)。
この閉塞状況を打ち破ったのがドイツのハンス・バーガーによる脳波の発見でした。頭皮上でヒトの脳の電気活動が記録可能となったのです。そして、バーガーの報告からわずか9年後の1938年には、アメリカのギブス夫妻が大発作(強直間代発作)、小発作(欠神発作)、精神運動発作(複雑部分発作)に特有な脳波変化をみつけています。とくに、精神運動発作(複雑部分発作)が頻発する難治部分てんかんでは側頭葉とその周辺に集中しててんかん性異常波が認められることが判明、側頭葉が難治てんかんを引き起こす元凶のひとつとして注目を集めるようになりました。
そして、1951年、シカゴの脳神経外科医ベイリーは、フレデリック・ギブス(ギブス夫妻の夫の方)の意見をとりいれ、精神運動発作(複雑部分発作)がみられ、側頭葉にてんかん性異常波が限局している難治てんかん症例の側頭葉を切除し、それまでとは比べものにならないくらいの確率で発作を抑制することに成功しました。病変の有無にかかわらず脳波というてんかんの探知機を頼りに皮質切除を行い、かなりの確率で発作を抑止できることを示しました。
これによって、てんかん外科治療の新たな地平が切り開かれました。
この後、まずは、側頭葉てんかんに対する手術が世界中で盛んに行われるようになります。
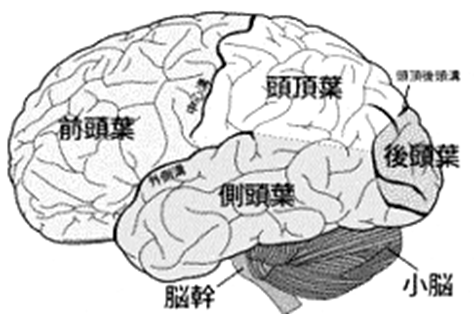
| 図7 脳の外側側面像 |
大脳半球は大きな溝、脳溝を境として前頭葉、頭頂葉、側頭葉、後頭葉の4つに区分されています(図7)。このうち側頭葉というのは頭頂葉の下方に位置し、前頭葉と後頭葉に挟まれるようにして側頭骨に包まれています。さらに、側頭葉は脳の内側へも入り込んでおり、この部分も側頭葉に含まれます。外からみえる部分を外側側頭葉、内側に隠れている部分を内側側頭葉と呼んでいます。
側頭葉は他の脳葉同様、数え切れないほどたくさんの機能にかかわっているものと推測されますが、外側側頭葉の主要機能の一つは外界信号を統合処理することです。外界刺激を認識し、過去の記憶と照らし合わせてその意味を判別するのです。一方、内側側頭葉は乳頭体、帯状回といった他の部位の神経細胞群(内側側頭葉の海馬、扁桃核を含め辺縁系と呼ばれています)とともに記憶に関与し、また、種の保存に必要な情動や自律神経機能を統合する役割を担っていることが知られています。
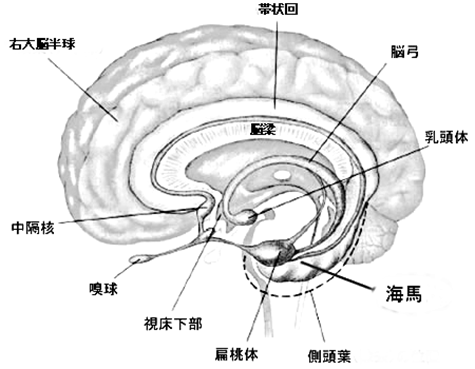
| 図8 脳の内側側面像と辺縁系 |
側頭葉てんかんは、この側頭葉に発作焦点があり、側頭葉起源のてんかん発作が繰り返し起きる病態のことです。当然のことながら、側頭葉てんかんでは発作時、そして、ときには発作の間にも、側頭葉の機能を反映した症状がみられます。
内側側頭葉にある海馬、扁桃体といった辺縁系組織はちょっとしたことでてんかん発作が発生しやすく(痙攣閾値が低いという言い方がされています)、代表的なてんかん発作焦点です。外側側頭葉に始まったてんかん発射は、急速に内側側頭葉に伝播、内側側頭葉で発作が励起されて、発作が持続、他の脳葉にまで異常放電が拡大していくことがあります。このため、内側側頭葉は「てんかん発作のペースメーカー」とさえ呼ばれています。20世紀半ば、薬剤抵抗性てんかんに側頭葉てんかんが目立って多いことが注目されたのは、このためでした。
内側側頭葉てんかんの代表的症状は「胃からこみ上げてくるような」異常感覚を感じた後、意識が消失、目がうつろとなり、口をもぐもぐさせたり、手に持っているものを弄んだりといった自動症に至る、というものです。自動症のみられる手とは反対の上肢が捻れ突っ張ることもあります。そして、ときとして、全身痙攣に至ります。内側側頭葉に発した異常放電が徐々に外側側頭葉をはじめとした周囲組織へと広がり、ついには脳全体を巻き込み、これに対応して前兆(単純部分発作)から複雑部分発作、そして、最終的に二次性全般化発作へと至るのです。前兆としては、先に述べた、上行性上腹部異常感覚以外にも、恐怖感、異常嗅覚、異常味覚、既視感、幻聴、幻視、めまいなどがみられます。20世紀半ば頃、精神運動発作と呼ばれていたものの多くがこの内側側頭葉からのこうした発作症状だったと推測されますが、その後、国際てんかん発作分類で他の部位からの意識消失を伴う発作とともに複雑部分発作と呼ばれるようになります。
この側頭葉てんかんの原因として20世紀半ばに話題の中心となったのが海馬硬化でした。
海馬というのは大脳の側頭葉内側にあるバナナのような形をした小指ほどの大きさの神経組織です。
1885年、フランスのブーシェたちは「精神疎外性発作」を有する患者の死後の脳でこの海馬が縮こまり、硬くなっていることをみつけ、さらに、ドイツのソマー(1880年)とブラッツ(1899年)はこの硬くなった(硬化した)海馬の錐体細胞層、とくにCA1領域とCA3領域において選択的に神経細胞が減少していることをみいだしました(図9)。しかし、当時、この変化はてんかんの原因というよりは結果だろうと考えられていました。
しかし、脳波が実用化された頃、薬剤抵抗性側頭葉てんかんの剖検例で海馬硬化が目立って多いことに気づかれるようになります。1953年、佐野圭司は海馬硬化(アンモン角硬化)と側頭葉発作(精神運動発作)の密接な関連を報告、ついで、イギリスのファルコナーは側頭葉てんかんの手術の際、側頭葉を吸引除去するのではなく(これでは切除した部位の組織像は分かりません)一塊にして切り取る術式を考案、切除標本の半数に海馬硬化像を見出しました。さらにかれは海馬硬化と幼児期の熱性けいれんとの関連も指摘して注目を浴びました。そして、その後、同様な報告が続きました。
こうして、海馬硬化病変は難治てんかん発作の結果ではなく原因であり、てんかん発作の強力な発火装置ではないかと考えられるようになりました。もともと、側頭葉切除がてんかん発作抑制において大成功をおさめたのも海馬硬化病変が原因のかなりの部分を占めていたせいだった可能性があります。海馬硬化では異常放電を作りだすべき神経細胞が減少しているのに、なぜ発作が起きやすくなるのか不思議ですが、神経細胞が脱落する一方で、異常神経線維が伸びて発火しやすい神経細胞網を形成しているのではないかと推測されています。しかし、本当のところは、まだ、よく分かっていません。しかし、いずれにしても、海馬硬化病変の切除をきっかけとして、てんかん外科治療は大きく前進することになりました。
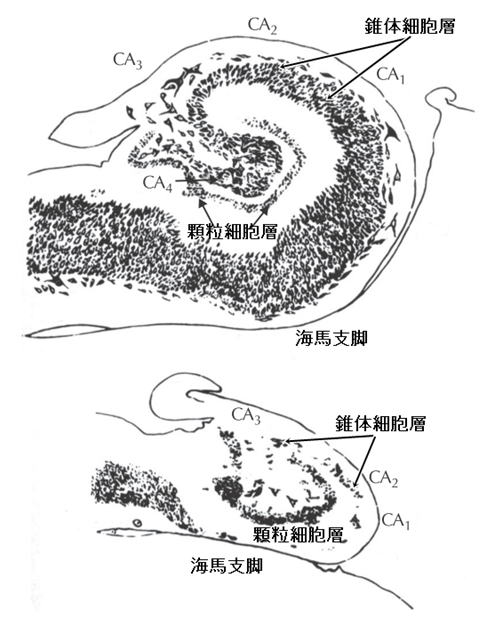
| 図9 正常海馬(上)と海馬硬化(下)の組織像海馬硬化においては錐体細胞層がCA1領域、CA3を中心に神経細胞が大幅に脱落する(下図)。しかし、錐体細胞層のCA2領域、海馬支脚は比較的保たれる。全体として海馬は縮こまる(Bratz(1899)改変)。 |
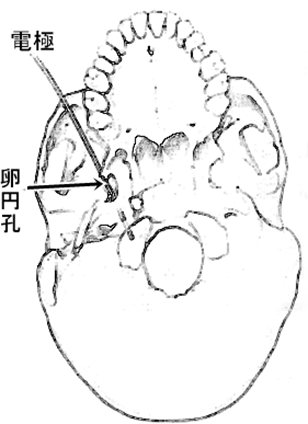
| 図10卵円孔電極卵円孔から電極を差し込むと先端を側頭葉内側の直上の位置にもっていくことができ、内側側頭葉の脳波活動が記録できる。 |
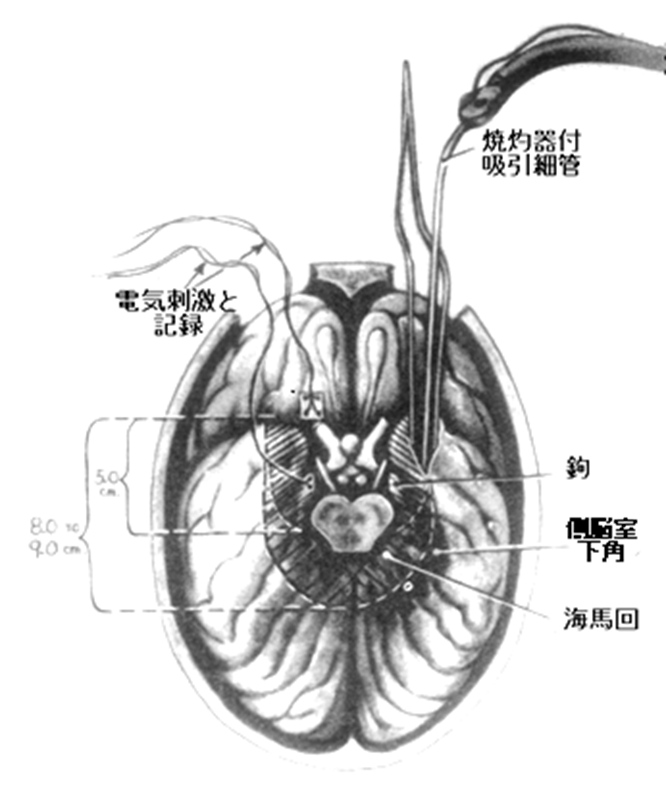
| 図11頭蓋内深部電極複数の電極と電極線を束ねる細い(現在は直径1-2mmの)チューブが内側側頭葉に向けて数本、挿入される。チューブ内には数個の電極が設置されており、内側側頭葉のみならず外側側頭葉の電気活動も記録可能。 |
ただし、一つ、問題がありました。海馬などの内側側頭葉は頭蓋骨から離れた部位にあります。電気信号は距離をおくと減衰してしまいますから、内側側頭葉の異常電気活動を頭皮脳波でうまく拾うことができません。そこで、何とか側頭葉の内側の脳波活動を捉えようとする試みがなされました。三叉神経の第3枝、下顎神経の通り道である卵円孔や頬骨のくぼみの蝶形骨から電極を差し込んで側頭葉内側近くで脳波を記録するのが一つの方策です。さらに進んで、側頭葉の外側から内側に向けて頭蓋骨を突き抜いて複数の電極を通した細いチューブを差し込む、頭蓋内深部電極による脳波記録が、フランスやスイスなどのヨーロッパを中心に行われるようになりました。脳から直接記録された脳波というと、ペンフィールドとヤスパーが局所麻酔した患者で術中に脳表においた電極から記録した脳波が有名ですが、ヨーロッパで考案されたこの頭蓋内深部電極は、手術前に何週間も留置しておくことができ、発作時脳波を記録できる機会が増えました。さらに、頭皮脳波と違って動きによる雑音が少ないため、深部電極では以前とは比べものにならないくらいきれいな脳波が記録でき、発作時のてんかん発射の起点、そして、てんかん発射が拡散していくさまをうまく捉えることができました。
さらに、脳波所見に映像を同期させる試みも始まりました。最初はフィルム撮影した発作症状を脳波と見比べることしかできませんでしたが、ソニーが業務用ビデオ映像記録装置Uマチックを開発すると、発作のビデオ映像と脳波映像を時間的にリンクさせるビデオ脳波同時記録が世界中の先進的なてんかんセンターで行われるようになります。そして、これがてんかん外科治療の術前検索にも活用されました。記録された発作症状と照らし合わせて脳波を何度も見直すことが可能となり、切除すべき発作焦点がより正確に特定できるようになったのです。
1970年代に入ると、こんどは画像検査に革命が起きます。コンピューター断層撮影(CT)が、ついで、磁気共鳴画像(MRI)が実用化され、ついに、脳の姿をみることができるようになったのです。とくにMRIの性能が上がって、撮影磁場が1.5T(テスラ:磁束密度)前後になったあたりから、海馬硬化や皮質形成不全といった薬剤治療抵抗性てんかんの主たる原因となる病変がくっきりと描き出されるようになりました。これによって、脳波所見と合わせ、てんかん外科治療における術前検査の精度が格段に上がりました。さらに、単一光子放射断層撮影(Single Photon Emission Computed Tomography(SPECT))、ポジトロン・コンピューター断層撮影(Positron Computed Tomography (PET))といった放射性同位元素を利用した機能画像技術が出現、てんかん外科治療の術前検査で活用されるようになりました。脳の血流、糖代謝、細胞膜上受容体の分布などを画像化する技術です。てんかん焦点では非発作時に血流、代謝量、受容体数が低下しており、逆に発作時には血流、代謝ともに増加しますから、MRIや脳波によって推定されたてんかん焦点をPETやSPECTによって機能面から評価できるようになったのです。
何らかの症状と病変を目安として「てんかん焦点」の切除をして始まったてんかん外科治療は、脳波記録の導入により、脳波所見を頼りに切除する時代に移行し、ついで、MRIなどの画像診断の進歩によって再び病変の存在が重視される揺り戻しがきました。内側側頭葉以外にも皮質形成異常、血管奇形、腫瘍、瘢痕組織が画像上に映し出され、それら病変の近辺からてんかん発作が開始していることが脳波によって確認されることによって、その病変とその周囲を切除する手術が行われるようになったのです。もちろん、脳波による発作焦点の確定が相変わらず主導的役割を担っていましたが、目に見える病変の存在が外科治療の背中を後押ししてくれました。こうして、内側側頭葉てんかん以外にもてんかん外科治療の手が伸び始めました。
ここで、また、新たな課題が出てきました。頭蓋内深部電極は側頭葉の脳波活動を拾うのには便利ですが、側頭葉以外の大脳半球外側面の電気活動を詳しく記録するのには向いていません。そこで、硬膜下にいくつかの電極を装着した紐(strip)を挿入して記録する方式が編み出されました。さらに、アメリカのクリーブランド・クリニックではリューダースたちがこの紐状の多極電極をいくつも並べて格子状にした電極を脳表上に敷き詰め、手術前評価に使い始めました。深部電極と異なり幅に余裕があるので、硬膜下電極では脳波を拾うだけではなく、外部から電気刺激ができるような配線も組み込まれ、これによって脳の機能を確認することもできました。こうした新たな頭蓋内電極の利用によってMRIなどでみつかった内側側頭葉以外のてんかん焦点を特定し、切除予定部位の機能を確認し、切除することも次第に行われるようになり、てんかん外科治療の幅が広がっていきました。

| 図12 硬膜下電極 皮質表面の脳波を記録するために数個の電極を配置した紐状のもの(右図)を硬膜下に差し込む方法が考案されたが、この電極をいくつか束ねた格子状のもの(左図)を敷き詰めて広範囲の皮質領域から記録する方式がクリーブランド・クリニックから提唱された。深部電極と違い硬膜下電極では幅に余裕があるため、電気刺激用の回路も組み入れて皮質機能も確認できるようになっている。 |
| メモ4 定位的頭蓋内脳波 最近になって再び深部電極は「定位的頭蓋内脳波」 stereo-electroencephalography (SEEG)という新たな名称で見直されている。電極留置を誘導する定位手術ロボット(能動的定位手術装置)の登場が見直しのきっかけになった。このロボットを使うと比較的安全に脳内に多数の深部電極(平均10~12本)を差し込むことができる。また、当初、フランスで行われていた海馬、扁桃体などの側頭葉内側構造物に加え、硬膜下電極では拾うことのできない前頭葉底部(眼窩前頭皮質など)、島回、帯状回などの深部皮質の脳波活動も捉えることができるようになり、こうした領域もてんかん焦点になりうることが認識されるようになった。さらに、電極を頭蓋骨から差し込むだけのSEEGは開頭が不要であり、患者負担が軽く、しかも、必要とあらば、あとから簡単に電極数を増やしうることも大きな利点である。さらに、再手術例など、硬膜下電極留置が難しい症例にも対応可能で、さらに広範囲の領域、両側半球からの記録が容易であることも普及を後押ししている。硬膜下電極のパイオニアであったクリーブランド・クリニックも、現在はSEEGに重点を移しているといわれており、日本でも2020年に頭蓋内電極植込術(K181-6)が保険収載され、各施設で行われるようになっている。日本てんかん学会からも運用指針が出されている(http://jscn.umin.ac.jp/files/info/SEEG_draft-guideline.pdf)。電極数は7本以上の留置が推奨されており、6本以下では、仮説を証明するには不十分なことが多いので、計画自体を見直すこと、15本以上の留置は合併症リスクが高くなる危険性があるため、計画を見直した上で、慎重に実施することが求められている。 |
症例HM
しかし、それとともに、以前からくすぶっていた問題が顕在化するようになりました。
てんかん焦点切除に伴う皮質機能喪失の懸念です。
てんかん焦点である脳の一部を切り取ると、切り取られた脳組織がかかわっていた機能が失われる恐れがあります。てんかん外科第一号といわれているホースリーの手術例でも術後に運動麻痺と感覚消失が認められています。最終的にこれらの症状は消失したようですが、てんかん外科の権威として尊敬を一身に集めていたペンフィールドの手術例でも、たとえば、後頭葉を切除して同名半盲が残った、などとさりげなく記載されています。同名半盲であればまだいいのかもしれませんが、中には、てんかん外科の結果、しゃべることができなくなる、といった許容しがたい機能喪失が生じるおそれもあります。
そうした機能喪失例の中でも、なかんずく有名なのが症例HMの記憶喪失です。
1953年9月1日、米国コネチカット州ハートフォード市のハートフォード病院で29歳の難治てんかんの男性HMに対し、両側の内側側頭葉を側頭葉先端から8㎝切り取る手術が行われました。手術を執刀したのはハートフォード病院の脳神経外科医、スコヴィルです。あとで述べる精神外科のアメリカにおける立役者の一人で、統合失調症300例前後に前頭葉眼窩回の皮質下切截術undercuttingを行なって名をあげていました。そして、HMの手術を行っていた頃には、さらなる効果を求めて内側側頭葉の吸引除去術を行うようになっていました。なぜ内側側頭葉を取り除こうとしたのか、いまひとつ、よく分からないのですが、「よく知られた眼窩回後部と内側側頭葉皮質の密接な関係に鑑み、眼窩回の皮質下切截術からさらに先に歩を進め、内側側頭葉皮質を破壊すれば精神症状に対するより良い効果を得られるかもしれないという期待があった」という説明がなされています。仮説をすぐに手術に結びつけてしまう当時の精神外科の典型的思考論理といえるかもしれません。最初は内側側頭葉の構造物のうち、比較的前方にある鉤と扁桃核に除去範囲を限定していましたが、そのうち、側頭葉先端から5cm、海馬前部を含んで吸引除去するようになります。範囲を拡げた理由もよくわかりません。しかも、さらに除去範囲を拡げ、ついには、一人の精神病患者では側頭葉先端から8cm、海馬の前方3分の2を含むと推定される部分も吸引除去したのです。
| 図13 HM症例の海馬切除の模式図 以前は側頭葉先端から5cmまでにとどめられていた内側側頭葉切除を症例HMでは8cmに延長、斜線部分が切除され、海馬はすべて消失したものと考えられる。以後、症例HMは生涯にわたって順行性健忘が続くことになった。 Scoville WB and Milner B (1957) Loss of recent memory after bilateral hippocampal lesions 一部改変 |
そして「一人の若い男性(HM)で同じように“過激な”内側側頭葉の両側切除を行った。さまざまな内科的治療を最大限行っても大発作と小発作をコントロールできないという長年の病歴があり、脳波上、広汎性異常が認められた」症例でした。これは「有り体に言って実験的な(frankly experimental)手術だった」と報告の中で認めていますが、「患者が発作のために完全に無力状態に陥り、内科的治療が難渋していたことから、この実験も正当化されるだろう」と考えたのだそうです。「鉤状回と海馬複合体のてんかん原性はよく知られており、側頭葉切除の自検例が他の部位の切除例と比べ術後発作のない例が比較的多い」からだというのです。発作を何とか鎮めるための手術だと術前に患者と家族には説明し、了解を得たとのことです(ただし、今と違って、医療訴訟もほとんどなく、医者の権威主義がまかり通っていた1950年代のアメリカにおける医療同意は今とは性質がかなり異なっていたと想像されます)。「手術時、両側の内側側頭葉を露出し、脳表電極と深部電極で脳波を記録したものの、明確なてんかん焦点は分からなかった」ようです。にもかかわらず、側頭葉先端から8cm、両側の内側側頭葉が吸い取られました。
術後数日、HMは嗜眠状態が続きました。しかし、やがて、しっかり目覚め、そして、すぐに、異変に気づかれました。HMの記憶が飛んでしまっていたのです。まず、手術を受けたことをまったく覚えていませんでした。そして、手術をした医師を含め病院職員のことも全員忘れていました。医師や職員の名前を何度教えられても、すぐに忘れてしまい、名前を忘れるのみならず、会ったことさえも忘れ、HMにとってすべての人間が初対面の人間になってしまいました。バスルームの場所もすぐ忘れ、何度教えられても覚えることができず、毎回、バスルームまで連れて行ってもらう必要がありました。過去のことも、少なくとも3年前に死んだ叔父のことは覚えていませんでした。ところが、3年以前のことはきちんと覚えていて、難なく思い出すことができました。一方、ちょっとしたことをわずかに思い出すことはあるものの、手術までの3年間の記憶はまばらでした。そして、新たに起こったことは何一つ記憶できませんでした(この男性は1957年の論文に症例HMとして報告され、以後、症例HMとして有名になりましたが、死後、本名がヘンリー・グスタフ・モレイソンHenry Gustav Molaisonであることが新聞で公表されました。以下、この男性をヘンリーと呼ぶことにします)。
困惑したスコヴィルはカナダのてんかん外科の権威、ペンフィールドに電話で相談しました。
ペンフィールドはヘンリーが手術をうけた翌年、1954年に刊行した有名な「Epilepsy and functional anatomy of human brain」に側頭葉てんかん患者に記憶障害が目立ち、海馬の機能不全が記憶喪失につながる可能性があることを記載しており、側頭葉切除が次第に過激になっていく風潮に懸念を示していました。このため、ペンフィールド自身は注意深く、片側海馬だけを切除するようにしていましたが、にもかかわらず、反対側の海馬が機能不全に陥っていたためか、片側側頭葉切除だけで記憶障害に陥ってしまった症例を経験していました。それだけに、スコヴィルの話にペンフィールドは激怒しました。しかし、ヘンリーの記憶喪失の医学的重要性に即座に気づき、彼の下で働いていた有能な心理学者ブレンダ・ミルナーをスコヴィルの病院に派遣しました。
ミルナーはヘンリーのみならずスコヴィルによって側頭葉を切り取られた症例にありとあらゆる心理検査を施行、これによって記憶に関する様々な知見が明らかにされました。とくにヘンリーの記憶にかんする解析は神経科学の新たな扉を開きました。
ミルナーは記憶と学習にかんする基礎理論を打ち立てたマギル大学のドナルド・ヘッブに学んだイギリス人です。ヘッブは神経接合部において神経伝達が繰り返されることによって信号伝達効率が変化し、これが記憶、ひいては、学習をもたらすという仮説を唱えていました。これをヘッブの学習則といいます。しかし、当時、その神経接合部の変化が脳の特定の部位に特化して起こるのかどうかは、まだ、よく分かっていませんでした。ところが、ヘンリーの記憶障害は記憶機能が内側側頭葉に局在することを明らかにしました。その上、記憶がさまざまな種類からなり、脳の特定部位が異なった記憶機能を受けもっていることも教えてくれたのです。
ヘンリーにみられた記憶障害は手術の約3年前までにさかのぼる記憶の喪失と新たな物事を覚える機能の喪失の2つに分かれます。過去の記憶の喪失を逆行性健忘、新たな物事の記憶能力の喪失を順行性健忘といいますが、ヘンリーには過去3年間に遡る逆行性健忘と、どこまでも続く順行性健忘がみられていたのです。ただし、ヘンリーは7桁までの数字を一時的に記憶することができました。しかし、それを保持できるのはほんのわずかな時間で、しかも、他に注意を削がれると、せっかく記憶されたものがすべてこぼれ落ち、二度と戻ってきませんでした。わずかな時間蓄えられる記憶を短期記憶といい、短期記憶で蓄えられたものが不完全ながらも長期にわたって残るものを長期記憶といいます。ヘンリーは内側側頭葉を吸い取られることによって、長期記憶が永遠に失われました。こうした記憶の種類と内側側頭葉の記憶における役割はヘンリーの記憶障害を詳細に検討することによって明らかになったのです。
それほどまでに記憶が壊れてしまっていたのに、ヘンリーの知能はまったく損なわれていませんでした。さらに、性格も術前と変わらず朗らかでした。過去の記憶と短期記憶があれば楽しめるからでしょう、ヘンリーはクロスワード・パズルがお気に入りで、パズルの本をつねに持ち歩いていました。ただし、パズルの内容をすぐ忘れてしまうので、同じパズルを何度でも楽しむことができました。あるとき、クロスワード・パズルに熱中しているヘンリーにある心理学者が「あなたはパズルの王様ね」と話しかけたところ、ヘンリーは微笑みながら振り返り「僕自身が謎(パズル)だからね」と答えたそうです。人を喜ばそうとするユーモアを生涯保っていたのです。
運動機能も正常でした。そして、記憶テストは新たな動作をヘンリーが苦もなく習得できることを示しました。ヘンリーが失ったのは新たな出来事を覚える機能で、これをエピソード記憶といいます。これに対し、自転車に乗ったり、泳いだり、走ったりといった無意識のうちに行う動作の記憶を手続き記憶といいます。ヘンリーは手続き記憶のほうは完全に保たれていました。現在、手続き記憶は小脳が関与していると考えられていますが、ヘンリーの手術では小脳は触っていませんから手続き記憶は手術前と変わらなかったのでしょう。こうしたこともヘンリーの検討から始まった記憶研究の発展によって説明可能となりました。
ヘンリーは内側側頭葉の構造物のうち、海馬に加え、鉤、扁桃核といった組織も吸い取られていました。しかし、先程もいいましたが、スコヴィルはヘンリーの手術の前に、何人もの患者で鉤や扁桃核を吸い取る手術を行っていました。ところが、そうした患者ではヘンリーにみられたような記憶の異常はみられていません。このことから、海馬機能があぶり出されました。短期記憶を長期記憶へと溜め込む上で海馬が決定的な役割を担っていることがわかったのです(ちなみに、前に述べたように、海馬に加え、乳頭体、帯状回などの脳の内側面の組織もエピソード記憶に関与していることが現在分かっています)。
前にも申しましたが、ペンフィールドは側頭葉と記憶の関連を推察していましたし、当時、そうした議論は他でもなされていました。しかし、それは海馬以外の組織の機能不全も含んだ「不純」な臨床症状からなされた推論にすぎませんでした。これに反し、ヘンリーの場合、スコヴィルが海馬を含む内側側頭葉の構造物だけを精確に吸い取ったために記憶機能脱落が「純粋」な形で示されました。海馬機能が浮き彫りにされたのです。術前検査と術式決定は信じられないぐらい粗雑でしたが、手術そのものにおいてスコヴィルは腕ききの脳神経外科医だったようです。杜撰かつ練達なてんかん外科手術が神経科学のまったく新しい地平を切り開いたのです。
しかし、記憶が失われたことによってヘンリーの内なる歴史は消えました。50歳を過ぎても、自らを手術前後の30歳ぐらいに思っていて、鏡にうつる齢を重ねた自分の顔に困惑していました。身の回りの必要品がどこにあるかも覚えられません。店の場所を覚えられないので店で買い物もできません。手足は自由で、物事の判断力もありますが、人の介助なしには何もできませんでした。家族も含めて助けてもらうという一点で人とつながっていました。ミルナーは、ヘンリーが「友情はもちろん、どんな人間的結びつきも不可能」になってしまった、とコメントしています。こうして、ヘンリーは絶対的な孤独の中で術後の人生を過ごすことになりました。
ちなみに、肝心のてんかん発作ですが、術後すぐには大発作が頻発しましたが、その後、おさまっていき、術前に比べ大幅に頻度が減って生活を妨げるほどではなくなりました。しかし、その効果を得るために生じた記憶の喪失はあまりに大きな代償でした。
神経心理検査
ヘンリーのような記憶喪失が起きないよう、現在、てんかん外科手術前には念入りな評価がさまざまな角度からなされます。脳波、画像とともにてんかん外科治療の術前検査を支える三本柱の一つ、神経心理検査です。
神経心理検査の中でもとくに有名なものが和田テストです。
北海道大学精神神経科の和田淳(Juhn Atsushi Wada)先生が考案された言語優位半球を確定する検査です。
ご存じのように、言語を司る中枢は左右いずれかの大脳半球に局在しています(運動性言語中枢(ブローカ中枢)は前頭葉下部、感覚性言語中枢(ウェルニッケ中枢)は側頭葉外側上部後方)。右利きの人の95%、左利きの人の60~70%は左半球に言語中枢があることがわかっています。しかし、それは確率としてそうだというだけで、一人一人についてみると、どちらにあるかわかりません。脳組織の一部を摘出するてんかん外科治療では、それでは困ります。そこで、和田先生は脳機能を短時間低下させる催眠鎮静剤、アモバルビタールを頸動脈に注入、言語機能の消失の有無をみて言語中枢がいずれの大脳半球にあるか判定する検査法を考案されました。頸動脈は大脳半球への血液の通り道ですが、意識に関係する脳幹は別の血管に支配されています。このため、頸動脈にアモバルビタールが注入されても意識は保たれ、同側大脳半球皮質の機能不全と反対側の半身麻痺(皮質運動野は対側の手足を支配しているため)だけが起こります。このため、アモバルビタールが注入されても言語が保たれるかどうかを評価することができ、頸動脈注入側大脳半球の言語中枢の有無が判定できます。和田先生は戦後間もない1948年に、この巧妙で大胆な検査法を試みられました。そして、その後、ペンフィールドが設立したカナダのモントリオール神経科学研究所に移られ、ここで行われていたてんかん外科治療の術前にこの内頸動脈アモバルビタール法を施行、その成果を公表されました。その結果はてんかん外科手術によって言語が失われる懸念を払拭してくれることを示していました。このため、この斬新な検査法はWada testの名のもと、世界中で行われるようになり、1980年代にはてんかん外科治療前の必須検査と見做されるようになりました。
| メモ5 今でも普通の医師ならちょっと身構えてしまうアモバルビタールの頸動脈注入を、終戦後間もない昭和23年に精神科医の和田先生が行ったということには驚かされます。ただ、臺弘は終戦直後の「昭和22年林道倫(岡山大学)教授の呼びかけで『精神分裂病の生物学的研究』班が発足して、私も岡山に招かれて初めて同志の方々と知り合いになった……林は分裂病の理解には脳の代謝を明らかにしなければならないと考えて、内頸静脈に穿刺して脳から戻ってくる静脈血をえて、同時に内頸動脈からの動脈血と比較して脳代謝を推定しようとしていた。クルズス(研修)を受けて私もやってみたが、内頸静脈の穿刺は深くて怖いとはいえ、それほど難しくはなかった」(臺弘『誰が風をみたか』)と書いています。この「同志」の中に和田先生もしくは北海道大学の精神科教室員が含まれていたかどうかは定かではありませんが、こうした終戦直後の日本の精神医学界を包んでいた熱気の中で和田テストが考案されたといえるのかもしれません。 |
和田テストは言語機能喪失のみならず、ヘンリーにみられた記憶喪失を予防する意味でも強力な武器になりうることがわかってきました。前にも言いましたように、片側の海馬に機能不全があると、もう一方の海馬切除で記憶障害をきたす恐れがあります。そこで、和田テストにおいて言語機能のみならず記憶機能の評価をすることが、同側の側頭葉の切除範囲を決定する上で必要と考えられるようになったのです。
ただし、海馬は内頸動脈以外からの血液供給も受けていて、和田テストの記憶評価にかんする信頼性は100%とはいえません。それに、頸動脈から麻酔薬を流すためには動脈穿刺、カテーテル挿入を必要とし、結構、侵襲度の高い検査です。このため、侵襲度のより低い検査法が考案され、さらに術式の変更(選択的扁桃体海馬切除術のような言語野のある外側側頭葉を残す切除方法)などもあって和田テストが行われる機会は徐々に減ってきました。代わりとなる非侵襲的検査としてよく行われているのが機能的磁気共鳴画像(functional Magnetic Resonance imaging : fMRI)です。言語課題、記憶課題に対する血流の増加をみて、優位半球を確定しようというものです。ただし、和田テストとの一致率は79~91%で、完全とはいえません。同様の原理でPET、SPECT、脳磁図なども優位半球の確定に用いられることがありますが、和田テストを必須としている施設は日本を含め世界中に残っています。
神経心理検査には、もう一つ、強力な武器があります。
頭蓋内電極です。
20世紀半ばまではてんかん外科手術は局所麻酔で行われ、術中に大脳皮質を電気刺激し、運動野や感覚野といった重要な機能を受け持つ皮質(機能領域eloquent area)を同定し、ここを避けて切除していました。ペンフィールドたちはこれを盛んに行い、副産物として皮質機能の重要な情報も数多くえられることになりました。しかし、前にも言いましたように、頭蓋内電極を使って皮質を電気刺激しても皮質機能を探り当てることができます。こうして、術前、皮質機能の同定が時間に追われることなく念入りに行うことができるようになったのです。
記憶の評価に関しては、対面的にさまざまな記憶関連テストを行い、記憶を体系的に評価する方法がミルナーを先達とするさまざまな神経心理学者によって考案されました。短期記憶と長期記憶、言語性記憶と非言語性記憶、即時記憶と遅延記憶など記憶のあらゆる側面を評価する検査です。
こうした対面で行う神経心理検査は言語や記憶以外の評価にも拡大され、患者さんの術後の生活を追跡する重要な武器にもなっています。1990年代、イギリスのテイラーはてんかん外科治療後に、一人一人の患者さんの家を訪れ、発作の減少や消失が生活にどんな影響を与えたかを神経心理検査を用いて評価しました。その結果をふまえ、難治てんかんの患者さんが、発作の低減のみならず、発作が生活にもたらしている窮状からの脱却をも切実に求めていることをテイラーは痛感したようです。そして、患者さんがてんかん外科治療の何に期待しているかを探り、治療決定に役立てるべきだと提言しました。テイラーの献身的な調査によって、対面神経心理検査はてんかん外科治療の術前、術後の評価に欠かせぬものとなりました。
このように、てんかん外科治療においては、術前にさまざまな情報を集め、検討し、ヘンリーのような重大な問題が起きないように、細心の注意を払って切除部位が決定されます。また、発作のみならず、患者さんの生活そのものを術前、術後を通じて注意深く評価するシステムができあがってきています。
てんかん原性領域
てんかん外科治療による機能の欠失を最小限に抑えるためには、てんかん発作を消失させるために必要な最小限の皮質を切除(もしくは線維連絡を切断)することが望ましいのはいうまでもありません。この「てんかん発作を消失させるために必要にして十分な最小限の切除皮質領域」をてんかん原性領域 epileptogenic zone といいます。硬膜下格子電極を術前検索に積極的に用いた米国クリーブランド・クリニックのハンス・リューダースはそれまで使われていたこの言葉を再定義しています。かれは、さらに、てんかん発作が始まる発作起始部ictal onset zone、発作間欠期脳波で棘波などのてんかん性異常波を認める易興奮領域irritative zone、てんかん発作の直接的原因となっているてんかん原性病変 epileptogenic lesion、発作症状が最初に引き起こされる発作症状発現領域 ictal symptomatogenic zone、発作間欠期に神経学的所見、神経心理学的検査、脳波、PETなどの画像検査で機能低下を示す機能低下領域 functional deficit zoneの5つをてんかん外科の術前検査を行う際に考慮すべき機能的、構造的解剖領域として挙げています(図14)。
てんかん原性領域 epileptogenic zoneは、ここをとってしまえば発作が止まる最小限の皮質部位なので、もし、それがいつも特定できるのであれば、手術で100%発作を止め、欠落症状も最小限に抑えることができることになります。しかし、残念ながら、そんなうまい話がいつもあるわけがなく、結局のところ、理論上の仮想皮質領域にすぎません。ただ、てんかん外科治療が目指すべき最終目的地であることは異論のないところで、術前検査ではそこにたどり着けるようあらゆる情報を集め、あらゆる方向から検討します。そして、それによって最終決定された部位を切除し、発作が止まれば、その切除部位の中にてんかん原性領域が含まれていた、ということになります。
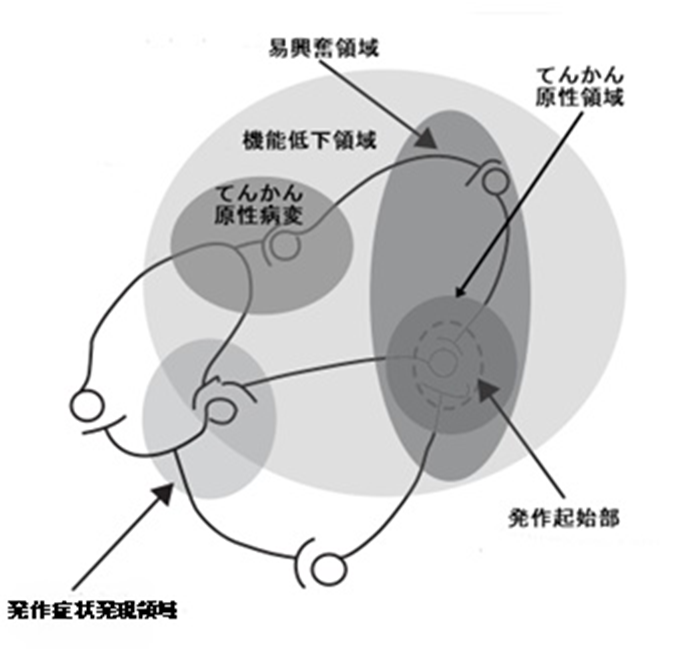
| 図14 焦点性てんかんにおけるてんかん焦点の概念図 焦点性てんかんの中には、海馬硬化、皮質形成異常、視床下部過誤腫のように病変そのものがてんかん発作の発生源となるものもあるが、血管奇形、腫瘍などは、自身は異常放電の発生源ではない。周囲を圧排したり、虚血に陥らせたりすることによって神経組織網をゆがめ、てんかん発作を誘発する。このため、てんかんの原因となっている病変(てんかん原性病変)とてんかん発作の発生地(てんかん原性領域)は必ずしも同一ではない。 てんかん発作はこのてんかん原性領域内の発作起始部から発生すると想定されているが、発作起始部は、現在の術前検査の技術ではピンポイントに正確に捉えきることができず、検出を誤る可能性がある。術前検査で特定した発作起始部のみを切除しても発作が止まらないことがあるのはそのためと考えられている。 てんかん原性領域とその周辺は電気的な興奮性が高まっていて、発作間欠期脳波で、棘波などのてんかん性異常波が認められることが多い。そうした領域を易興奮領域と呼ぶ。通常、てんかん原性領域は易興奮領域内にある。 発作起始領域から始まった異常放電は発作起始領域の皮質機能を反映した症状を示すとはかぎらない。発作起始領域の異常放電によってもたらされる皮質機能異常が臨床症状をきたさない silent area(沈黙野)である可能性があるからである。このため、異常放電が広がって発作症状を示すようになる皮質領域(発作時症状発現領域)は、発作起始領域とは異なる場合がある。 てんかん原性病変、てんかん原性領域、易興奮領域を含む皮質領域は機能画像上、活動が低下している(発作時は逆に活動が亢進している)ことが多いので、これを機能低下領域 functional deficit zone と呼ぶ。(Nair DR, Lüders H (2004) A critical review of the different conceptual hypotheses framing human focal epilepsy 改変) |
てんかん原性領域としては、てんかんを引き起こす原因となっている病変がまず思い浮かびます。実際、脳内病変がてんかん発作に直結していると想定し、病変とその周辺を切除することがてんかん外科では行われてきました。しかし、画像でみえている病変が必ずしもてんかん原性領域とは限りません。たしかに、皮質形成異常、海馬硬化病変、視床下部過誤腫のように病変そのものからてんかん発射が発生する病変はあります。しかし、血管奇形、腫瘍のように、自身は異常放電の発生源とはならず、圧迫や虚血誘発などによって周囲の神経組織網を歪め、てんかん発作を発生させている病変もあります。それに、たとえば皮質形成異常はMRIで認められる異常陰影よりも広い範囲に“隠れ”ていることがあって、その“隠れ”た病変が発作の主要起始部になっていることさえあります。また、視床下部過誤腫も正常視床下部との境界線が捉えづらく、そのことが視床下部過誤腫の治療を困難にしています。いずれの場合も、てんかん発作を引き起こす病変だけを切り取ることが実際には難しく、手術にあたっては総合的な判断を要します。
このように画像診断で捉えられる病変をてんかん原性領域とイコールとは言い切れないことがままあります。もちろん、てんかん原性病変がてんかん原性領域を定める上で重要であることはいうまでもありません。あとで述べますが、画像上でてんかん原性病変が捉えられるかどうかで、てんかん外科手術の成績が大幅に異なる(病変がわかっている場合のほうが手術成功率は圧倒的に高い)ことからもそのことがよくわかります。
てんかん外科の歴史上、てんかん症状をもたたらす皮質領域、発作症状発現領域も重要な役割を担ってきました。ホースリーがはじめててんかん外科を開始した際にもジャクソンが発作症状から推定した皮質領域の切除が行われました。しかし、残念ながら、発作時症状発現領域がてんかん原性領域と同一とは限りません。なぜなら、てんかん発射が始まっても、異常放電によってはっきりとした発作症状を示さない皮質領域(沈黙領域 silent area)が少なからず存在するからです。このため、発作が始まっているにもかかわらず発作症状が現れず、異常放電が運動野などの発作症状をもたらす皮質領域へと広がっていって初めて発作症状が出現することがありうるのです。いうまでもなく、この場合、運動症状を引き起こした運動野はてんかん原性焦点ではありません。
しかし、だからといって、発作症状がまったく役に立たないというわけではありません。当然ですが、てんかん原性領域が発作症状の始まりを引き起こした皮質の近くにある可能性が高いからです。ですから発作症状はてんかん原性焦点を特定する上で重要な情報を提供してくれることに変わりはありません。とくに、てんかん原性領域が左右いずれの大脳半球にあるかを決める際には発作症状は有力な手がかりになります。側頭葉てんかんなどでよくみられることですが、発作時脳波も含め、てんかん性異常脳波所見が左右いずれにもみられ、左右大脳半球のいずれがてんかん焦点なのか決めかねることがあります。そうした場合、発作症状が重要な情報を提供してくれます。左右いずれかの大脳半球からしか現われない症状、兆候があるからです。これを発作の側方徴候といいます。側方徴候のすべてが信頼できるわけではありませんが、てんかん原性領域を確定していく道筋の中で有力な標識となります(表7)。
| 側方徴候 | 側方性 | 推定関連領域 | 特異度 | |
| 発作中徴候 | 片側頭痛 | 同側 | 硬膜、三叉神経 | 90% (TLE), 12% (ETLE) |
| 片側視覚前兆 | 反対側 | 視覚野 | 100% (後頭葉) | |
| 片側上下肢強直 | 反対側 | 一次運動野・運動前野 | 83-92% (TLE) | |
| 頭部回旋 | 反対側 | 前頭前野・運動前野 | 100% | |
| 2次性全般化発作終了時の間代 | 同側 | 前頭前野・運動前野 | 100% | |
| 1側ジストニー肢位 | 反対側 | 基底核 | 98.8-100% (TLE) | |
| 1側の発作時麻痺・無動 | 反対側 | 陰性運動野 | 100% | |
| 反応性が保たれた自動症 | 言語非優位側 | 100% (TLE) | ||
| 尿意切迫 | 言語非優位側 | 前頭葉内側面、 内側側頭葉、弁蓋部 | 100% (TLE) | |
| 発作性発声 | 言語優位側 | Broca野、補足運動野など | 81.8% | |
| 発作時 Gerstmann症候群* | 言語優位側 | 角回 | 100% | |
| 発作後徴候 | 運動麻痺(Todd麻痺) | 反対側 | 一次運動野、基底核 | 93-100% |
| 発作後の飲水 | 言語非優位側 | 扁桃体、島、一次運動野 | 92-97% | |
| 発作後のあくび | 言語非優位側 | – | 100% | |
| 発作後の空間的見当識障害 | 言語非優位側 | 頭頂・後頭葉 | 84.6% | |
| 表7 発作症状・徴候と側方性 TLE:側頭葉てんかん、ETLE:非側頭葉てんかん *Gerstmann症候群:失算、失書、左右障害、手指失認を認める症状群で、頭のなかでイメージを回転させた形で認識できないことが症状発現に関与するといわれている 寺田清人(2011)改変 (頻度、特異度の高いもののみを列挙) | ||||
前に述べましたように、発作間欠時脳波で棘波や鋭波が認められる易興奮領域 irritative zone はてんかん焦点を指し示す指標として、てんかん外科のみならず、てんかん診療全体に革命をもたらしました。そして、現在もてんかん原性領域を探り当てる有力な手段です。しかし、易興奮領域がそのままてんかん原性領域ではありません。脳波といえばとりあえずは頭皮脳波ということになりますが、以前にも述べましたように、てんかん患者さんで頭皮脳波に棘波がみられないことは少なからずあります。これは、脳の表面のかなりの部分が頭皮の真下にないため、頭皮脳波ではてんかん放電を漏れなく拾うことができないためと考えられています。さらに、棘波を発生する皮質面積が6平方センチメートルを超えないと頭皮脳波上では棘波が現れないことも頭に入れておく必要があります。実際、6平方センチメートル以下の(頭蓋内電極上の)易興奮領域が結構あるのです。そうした例では脳が発する異常脳波活動を頭皮脳波で確認することはできません。脳磁図など他の方法でこの点をカバーすることはできますが、完全ではありません。
では、直接脳から記録した頭蓋内電極による易興奮領域がてんかん原性流域なのかというと、これも、必ずしもそうとはいえません。てんかん原性領域は、おそらく、易興奮領域の中のどこかに局在しているだろうと考えられますが、易興奮領域は、通常、てんかん原性領域よりずっと大きいのです。たとえば、一側の海馬硬化病変からてんかん発作が出現している場合に、両側の側頭葉から発作間欠期に棘波がみられることがあります。しかし、両側にてんかん原性領域があるわけではありません。いずれかの棘波はてんかん原性領域の影響を受けた結果として表れているにすぎません。このように、発作間欠期の棘波などのてんかん放電はてんかん原性領域よりもずっと広い領域で出現するのが普通です。
難治てんかんの患者さんでは、発作間欠期、神経学的にも神経心理学的にも皮質の一部に機能低下がみられることがありますが、画像的にも血流低下(SPECT)、ブドウ糖の取り込み低下(FDG-PET)といったような形でてんかん原性領域の周りに機能低下が示されることがあります(図16,17)。てんかん焦点やてんかん放電が伝搬する領域では過剰な神経活動によって通常の皮質機能が低下するためではないかと考えられています。機能が低下しているようにみえるこの皮質領域を皮質機能低下領域と呼んでいるわけですが、図16,17をみてもらうと分かりますが、皮質機能低下領域は易興奮領域以上に幅広い領域に広がっていることが普通です。皮質機能低下領域もその内部にてんかん原性領域を含んでいて大事な情報を与えてくれますが、てんかん原性領域そのものではありません。
最後が、てんかん発作が始まる発作起始領域です。普通に考えれば、ここがてんかん原性領域のはずで、事実、ペンフィールドなどは易興奮領域も勘案しつつも発作起始部をてんかん原性領域とみなして手術をしていました。ところが、頭蓋内電極による発作時脳波で発作起始領域を確定したのち、その部分を切除しても、時として、発作が止まらず、切除後、他の部位から発作がでてくることがあります。
理由は二つ考えられます。
ひとつは、技術的な問題です。頭皮脳波の発作時脳波記録が当てにならないことは発作間欠期のてんかん放電と同じです。6平方センチメートル以上に異常放電が広がらないと発作を示唆する変化が頭皮脳波では捉えられないのですから、発作起始とみえる突発波も、頭皮脳波では、てんかん焦点からある程度広がったものをみていることがありえます。この場合だと、発作起始点は特定できません。では頭蓋内電極で捉えた発作起始点だったらいいのかというと、じつは、これにも問題があります。電極配置に限界があるからです。硬膜下電極にしろ、深部電極にしろ、頭蓋内電極を無限に敷き詰めたり、差し込んだりすることはできません。狙いを定めたところに電極を敷き詰めたり刺したりするのですが、これでは限られた領域の脳の活動しか拾えません。もちろん、発作症状、発作間欠期脳波所見、画像所見などから、議論に議論を重ね、最終的に、発作起始部と疑われるところに頭蓋内電極を設置するのですが、しかし、それでも、脳のすべてに万遍なく電極を配置しているのではありません。狙いが外れて、発作起始部ではないところに電極を設置する恐れがあります。
実際、発作起始領域をすべてとったはずなのに、術後、その隣接部位から発作が起きていることが発見されることがあります。リューダースは切り取った方の発作起始部を実在性発作起始領域(actual seizure-onset zone)と呼び、それに隣接した残存発作起始部を潜在性発作起始領域(potential seizure-onset zone)と呼びました。
リューダースの考えでは実在性発作起始領域と潜在性発作起始領域をあわせたものがてんかん原性領域ということになります。しかし、それとは異なる考えもあります。深部電極を術前検索に使っていたフランスの研究者たちは発作起始部領域のみならず、発作が広がってゆく領域も観察し、発作伝搬領域も発作形成に深く関与しているのではないかと疑っていました。そこで、手術に当たっては発作が広がっていくこの領域も含めて切除すべきと主張しました。ここから、発作をもたらす神経集団は、てんかん焦点という点で考えるのではなく、発作を起こす神経細胞集団ネットワークの機能異常と捉えた方がいいのではないかという考えが出てきました。点ではなく塊です。あるいは、点ではなくつながりです。そう考えると、発作時脳波で捉えられた一点だけを取り去っても、他の部位から発作が始まるのも、ある程度、説明がつくのではないかというわけです。事実、このてんかん発作をもたらすネットワーク形成は動物実験などでいくつも証明されています。しかし、てんかん発作をネットワークで考える論法も、いろいろ、問題があります(Zaveri HP et al (2020)。まず、なによりも、「発作が広がっていく領域」というのは本当に異常な神経細胞集団なのか、という疑問があります。発作が広がっていくといっても、単に、正常な神経細胞網を異常てんかん放電が伝わっていくだけなのかもしれません。もし、そうなら、そんな正常細胞網を切り取る必要があるのかと疑問が生じます。ところが、そもそも、ヒトの正常神経細胞網とは何なのかについても、じつは、よく分かっていません。実際には、発作が進展する領域を切除しなくても発作が止まる例があります。ですから、これに対するしっかりした回答は今のところありません。
このようにてんかん原性焦点を同定するのは一筋縄ではいきません。実際のところは上に述べたさまざまな領域を確定し、多様な角度から検討してこの部位がてんかん原性焦点だろうという仮説を立てます。そして、この仮説の下にさらなる検査を追加し、手術前の最後の最後まで、検討を加えていきます。これは、切除を行う一人の外科医ができることではありません。てんかん外科がチーム医療だと言われ、さまざまな専門家が集まった病院なり施設で行う必要があるのはこのためです。
ちなみに、追加する「さらなる検査」として、最近、注目を浴びているものに高周波脳波活動である高周波振動(High frequency oscillation(HFO))があります。
脳波活動の周波数は、かつては 0.3~70Hz とされてきました。しかし、脳から発せられる電気活動はこの周波数帯域に限定されるわけではありません。もっとずっと幅があります。ただ、昔は脳波をペンと紙で記録していましたから、ペンと紙の物理特性に縛られ、記録できる脳波の周波数には限りがありました。脳波活動が 0.3~70Hz とされていたのはそのせいです。しかし、20世紀後半、ペンと紙を使わず、脳波をデジタル信号で取り込んでモニター上に映し出すデジタル脳波計が登場しました。すると、デジタル信号には制限がありませんから0.5~70Hz を超えた幅広い周波数の脳波活動が臨床医の視野に入ってくるようになりました。この拡大された脳波活動のうち、80Hz以上の高周波脳波活動を高周波振動と呼んでいます。デジタル脳波計導入後、発作間欠期に記録されるこの高周波振動が発作起始部に一致してみられることがわかってきました。さらに、高周波振動が高頻度にみられていた脳部位を切除するとてんかん外科手術の発作抑制率が高いことが報告されるようになりました。つまり、高周波振動がてんかん原性焦点を指し示すマーカーではないかと期待され始めているのです(Frauscher B et al (2017))。まだ、高周波振動の評価は記録方法も含め十分には定まっていません。しかし、てんかんを指し示す指標として薬物治療への応用も検討されはじめています。
外科治療成績
このように、新たな技術を吸収しながらてんかん外科治療は有効率を高め、手術に伴う機能喪失を減らし、順調に成績をあげてきました。
しかし、一つ、問題がありました。
てんかん外科治療はアメリカ、カナダ、イギリス、フランス、スイスなどさまざまな国で各々独自に発展したため、術前検査、術式、治療成績の評価方法がバラバラだったのです。そこで、1992年にてんかん外科に関わる世界中の人々が集まってアメリカで会議が開催されました。会議ではてんかん外科のさまざまな側面について議論が交わされ、幅広い合意がなされました。中でも重要な議題が術後の評価方法の統一でした。そして、さまざまな議論を経て、予後分類(エンゲルの予後分類)が公表されました。ようやく、てんかん外科の国際標準の治療指標が整えられたのです。
その後のてんかん外科治療の進歩もあって、切除てんかん外科の成功率は1986年から1999年の13年間の間に43%から85%へ飛翔したと推定されています。この推計が可能だったのもエンゲルの予後分類という治療指標のおかげでした。部位別では完全発作消失率が側頭葉切除では55%から70%に、側頭葉外切除では30%から50%に上昇したと推定されています。このエンゲルの指標は長い間てんかん外科の予後判定に広く使われました。しかし、明確な数値が示されておらず、曖昧さが残っているという意見もあって、2001年には国際抗てんかん連盟による予後分類案も提唱されています。
| 表8 エンゲルによるてんかん外科治療術後予後分類 (Engel et al. (1993)) クラスI 生活に支障がある発作の消失 A: 手術後、発作完全消失 B. 手術後、生活に支障のない単純部分発作のみ C. 手術後、生活に支障のある発作があったが、その後、生活に支障のある発作が最低2年はない D. 抗てんかん薬中止時にのみ全身けいれん発作 クラス II まれに生活に支障のある発作(ほとんど発作がない状態) A. 最初は生活に支障のある発作が全くなかったが、現在、まれに、生活に支障のある発作がある。 B. 手術後、まれに、生活に支障のある発作がある。 C. 手術後、生活に支障のある発作がまれならずあったが、最近2年間はまれにしかみられない。 D. 睡眠時発作のみ クラス III 発作改善とみなしうる A. 発作が減少したといえる B. 経過観察の半分以上の期間で遷延発作がないが、しかし、その期間は2年未満 クラス IV 発作改善とはいえないわずかな発作減少発作に変化なし発作悪化 |
| 表9 てんかん発作の予後にかんする新分類提案 ILAE Commission Report(2001) | |
| 予後分類 | 定 義 |
| 1 2 3 4 5 6 | 完全なる発作消失;前兆なし 前兆のみ;他の発作なし 年に1-3日の発作;±前兆 年に4日の発作~基底発作発生日数の50%以上の減少 基底発作発生日数の50%以下の減少~100%以下の増加 基底発作発生日数の100%以上の増加 |
外科治療の対象
このようにてんかん外科治療は脳波技術、画像技術、神経認知機能評価技術の発展に後押しされて洗練され、成績を上げ、てんかん治療の有力な一角を占めるようになりました。
しかし、前に述べましたように、薬でうまくコントロールできないてんかんがすべて外科治療の対象になるわけではありません。現在のところ、手術によって治療可能なてんかん(surgically remediable epilepsies)は主として次の5つです。
- 内側側頭葉てんかん
- 器質病変が検出された部分てんかん
- 器質病変を認めない部分てんかん
- 一側半球の広範な病変による部分てんかん
- 失立発作をもつ難治てんかん
これ以外のてんかんについては、現在のところ、発作のコントロールも含め、外科治療によって難治性てんかんを有する患者さんの生活の質が向上するという確証がありません。ただし、外科的治療の対象となるこの5つのてんかん類型に属するかどうか断言できない患者さんも中にはみえます。ですから、最終的にはケースバイケースで外科治療の適応を判断することになります。
てんかん外科治療の対象となるこの5つのてんかんのうち、1番から4番までは、異常放電が脳の一部から始まるてんかん発作、すなわち、部分発作がみられるてんかんです。手術にあたっては、異常放電を引き起こす部位がどこにあるのか見当をつけ、てんかん焦点を可能なかぎり切り取ります。これを切除外科と呼んでいます。
これに対し、5つめの「失立発作をもつ難治てんかん」に対する外科治療というのは、左右大脳半球をつなぐ脳梁という神経繊維の集団を切断して、神経伝達を遮断(離断)し、てんかん放電が広がっていかないようにする術式です。これを遮断外科といいます。切除外科と異なり、遮断外科では、てんかん発作の元凶となっている神経集団を取り除くわけではありません。発作の源に手をつけないのですから、原理上、発作の完全抑制は望めません。異常放電が脳全体に広がっていくのを阻止し、軽い発作にとどめよう、というのがこの手術の狙いです。
ちなみに、遮断外科治療としては、もうひとつ、軟膜下多切術(MST)というものもあります。
てんかん焦点であればどんな皮質でも切り取ってしまっていいというわけではありません。前にも申しましたが切除すれば、まず間違いなく、ひどい機能障害をきたす恐れがあり、切除できない皮質領域(eloquent areas)があります。たとえば、言葉をコントロールする運動性言語野。ここをとってしまうと、話すことができなくなる恐れがあります。 しかし、てんかん焦点が運動性言語野を含んでいることが明きらかな場合、何かしなければ発作を押さえ込むことはできません。その工夫の一つとして、運動や言語といった重要な機能を司る皮質に垂直に切れ込みを入れる術式が提唱されました。それが軟膜下多切術です。大脳皮質では皮質表面に対して垂直な柱状の神経細胞集団が機能単位を形成していることがわかっています。そして、機能を発揮する際の信号も表面に対して縦方向に流れています。ですから、大脳皮質に垂直方向へ切れ込みを入れても、皮質機能はあまり阻害されません。一方、てんかん発作を引き起こす異常放電は水平方向に伝搬していくことが知られています。皮質運動野の機能に沿ってけいれんが手の先から肩に向かって順番に拡がっていくジャクソン発作はそのことを如実に示す例です。そこで、正常神経機能の脱落を防ぎ、かつ、発作の伝搬を押さえるために、皮質に垂直方向にいくつもの切れ込みを入れるのが軟膜下多切術です。皮質をとってしまうのではなく、皮質の神経相互の連絡を断ち切るわけで、その意味では遮断外科治療ということになります。しかし、軟膜下多切術を行って発作が減少して、最初はいいようにみえても、あとになって結構発作が再発するという報告がなされており(Polkey & Smith, 2008)、いまだ議論の多い術式です(2000年代に入ってから、この術式を扱った英語論文はほとんど見当たりません)。
内側側頭葉てんかん
内側側頭葉てんかんというのは、前にも触れたように、発作を起こす異常放電が海馬、海馬傍回、扁桃体といった側頭葉の内側構造物からはじまるてんかんのことです。
内側側頭葉てんかんの病因としては腫瘍、先天性の脳形成異常、瘢痕組織などさまざまなものがあります。しかし、その中でもっとも多いのが先ほど述べた海馬硬化です。海馬の神経細胞が脱け落ち、グリア細胞と置き換わって小さく堅くなっている病変です。手足に擦り傷ができると、皮膚の細胞が剥げ落ち、代わりに新たな皮膚と結合組織が増生して、傷口がやや堅くなって傷が治ります。実態は異なりますが、それと似たようなことが側頭葉内部で起こっていると考えていただけると、少しはこの病変のイメージが湧くかもしれません。この「傷跡」の海馬には剥げ落ちた神経細胞に代わって、新たな神経細胞による「乱れた配線」の異常神経細胞網が形成されています。そして、ちょっとしたことで神経細胞間の電気の流れが乱れ、てんかん発作が起きやすくなっています。
ただ、海馬のこの「傷跡」がどうしてできるかについては、昔からさまざまな説が提唱されていますが、いまだに結論がでていません。
海馬硬化にみられる「傷跡」的所見は海馬周囲の嗅内皮質や海馬傍回、扁桃体にも認められます。それらはすべて側頭葉の内側にありますから、海馬硬化は内側側頭葉硬化(mesial temporal lobe sclerosis)と総称されています。
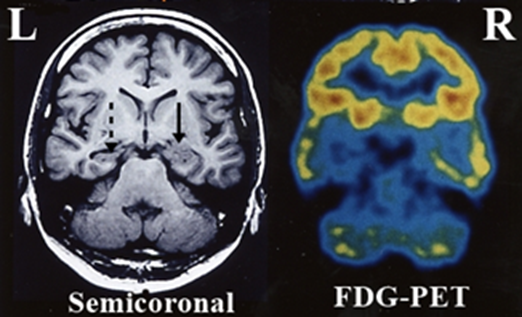
| 図16 内側側頭葉てんかんのMRIとポジトロンCT 左のMRI冠状断で下方両側に房のように突き出ている脳葉が側頭葉で、内側にみえる灰色の塊が海馬であり、左海馬が右(矢印)に比べ小さくなっている(破線矢印;海馬萎縮)。ポジトロンCTでも右海馬は索状に黄色く写っているのに、左海馬には黄色のものはみられない。これは、左海馬では神経細胞の脱落もあってエネルギー源である糖の取り込みが低下していることを示している。 |
内側側頭葉硬化のある患者さんは家族歴、病歴、発作症状、脳波所見、画像所見、臨床経過がよく似ています。
家族、親戚にてんかんをもつ人が結構いますし、最初のてんかん発作が乳幼児期の熱性けいれん、それも、重積状態に至るような重篤な熱性けいれんということが少なくありません(3-4割の方が重積発作で発症するという報告もあり、重積発作によって選択的に海馬を初めとする内側側頭葉が障害されて、内側側頭葉硬化になるのではないかという説が昔から唱えられています。しかし、上に述べましたように、本当にそうかどうか、まだ結論は出ていません)。この重積発作のあと数か月から数年は何ごともなくすぎます。しかし、そのうちに、前兆を伴った複雑部分発作が繰り返しみられるようになります。平均すると10歳前後のことです。その発作症状は内側側頭葉起源を疑わせるもので、実際、脳波上にも側頭部にてんかん放電を認めます(図17)。
しかし、この複雑部分発作は、最初、簡単にコントロールされることがあります。抗てんかん薬を服薬することで、数年、発作がない状態が続くことがあるのです。薬を一旦、中止できることさえあります。
ところが、数年後、発作が再発します。
そして、こんどは、以前効いていた薬も含め、どの抗てんかん薬も発作を止めることができません。月に数回、ひどいと、日に数回といった頻度で、頻回に発作が起きるようになります。精神的にも不安定になり、記憶力も低下、学校生活、社会生活に支障をきたすこともまれではありません。そして、MRIで側頭葉内側の海馬などの萎縮、異常信号がみられます (図16)。SPECTあるいはPETといった機能画像検査では同部位およびその周囲の脳血流低下、ブドウ糖の取り込みの低下が認められます。
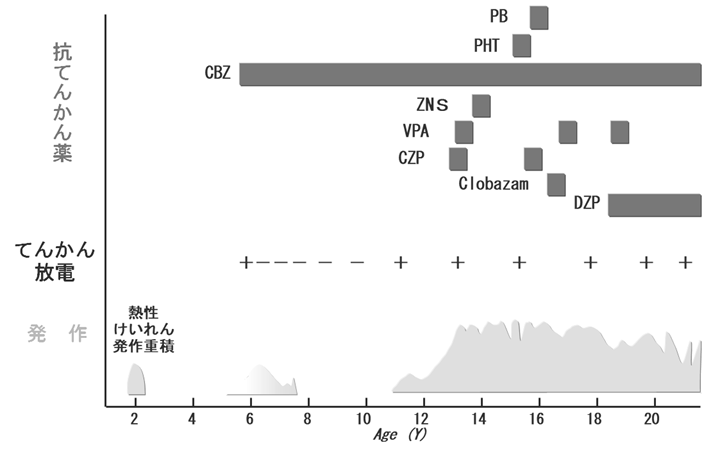
| 図17 側頭葉内側硬化てんかん 22歳 男性 2歳のとき、発熱にともなって、右半身けいれんが1時間近く続いた。5歳頃から、気持ち悪そうな顔をして、目がうつろとなり、反応がなくなる発作がみられるようになった。左側頭部に棘波が認められ、カルバマゼピン(CBZ)の服用を開始したところ、数か月で発作は消失し、脳波上の棘波もみられなくなった。しかし、11歳のとき、「胃からこみ上げるような」違和感を訴えたあと、反応がなくなり、右手を突っ張り、左手をもぞもぞさせる発作が出現した。この発作は以前と異なり薬に反応せず、さまざまな薬を試みたが、発作は消失しなかった。MRIで左側頭葉内側の海馬が萎縮し、代謝が低下していることが判明した(図16)。 |
このように、内側側頭葉硬化による側頭葉てんかんの多くはきわめて難治の経過をとります。
ところが、薬物治療に抵抗性を示すこの難治てんかんに対し、外科治療が絶大な効果を発揮します。
発作の焦点となっている側頭葉の前部もしくは側頭葉内側組織を切り取ることによって、60-70%の方で発作が消失するのです。発作が消失しないまでも、大多数の方で発作頻度が激減します。そして、発作の改善とともに精神的にも落ち着きがみられるようになります。脳を切除したことによる脱落症状はほとんどみられませんので、社会復帰し、普通の生活に戻られる方も少なくありません。
このように、内側側頭葉硬化に外科治療はきわめて有用です。以前にも述べましたが、歴史的にみても、てんかん外科の有用性が最初に認められたのが、この内側側頭葉硬化に対する手術でした。そして、現在でもてんかん外科治療の半数前後が内側側頭葉硬化を対象としています(昔は半数以上を占めていましたが、MRIの進歩によって他の部位の切除術が増えたこと、また、側頭葉以外に発作焦点が多い小児のてんかん外科治療が増えたことで、てんかん外科に占める割合は徐々に減ってきてはいます)。
内側側頭葉硬化によってもたらされるてんかんは、このように比較的定型的な臨床経過をとるため、臨床的には内側側頭てんかん症候群と総称されています。症候群として認識すると、診断も容易ですし、なによりも、手術をやるべきか否かの判断がつきやすい利点があります。また、切除すべき皮質焦点もわかっていますから、切除術式も患者さんごとに工夫する必要があまりありません。詳細な術前検索も無用なことがほとんどです。7-8割の方では、頭蓋内電極を留置するといった侵襲的な術前検査を省略して切除術が行われます。ただし、切除を回避すべき側頭葉外側にあとで述べる皮質形成異常が合併していることもあるので、その可能性が示唆される場合は、頭蓋内電極の留置を考慮することもあります。また、切除手術時、切除の予定に入っていない側頭葉外側面に電極を直接おいて皮質脳波を記録し、てんかん原性が高くないか確認することもあります。
ちなみに手術成績はてんかん発症から手術までの期間が短ければ短いほどいいことがわかっています。不幸にもこのてんかん症候群に罹患されているとわかった方は、難治てんかんと判明した時点で、勇気を奮って手術を決断されることが望まれます。
器質病変が検出された部分てんかん
てんかん外科の対象の多くは、異常大脳皮質に起因する難治性部分てんかんです。内側側頭葉てんかんはその典型例ですが、内側側頭葉てんかん以外の難治性部分てんかんは、MRIなどの脳画像検査をもとに、大きく2つに分けられています。
一つは「画像検査で明らかな病変がみられる部分てんかん」です。もう一つが「画像検査でどれだけ詳しく調べても明らかな異常病変がみつからない部分てんかん」です。
どうしてそのような分け方をするかといいますと、この2つの難治性部分てんかんが、術前検査も、術式もかなり異なり、そして何よりも外科治療による予後が違うからです。画像上、病変(てんかん原性病変epileptogenic lesion)がはっきりしている部分てんかんのほうが外科治療による予後がはるかにいいのです。
画像でてんかん焦点を疑わせる病変が描出されるてんかんは「器質病変が検出された部分てんかん」と呼ばれています。
てんかん外科治療の対象となる器質病変としては良性腫瘍、血管腫、皮質形成異常、外傷や血管障害による脳軟化巣およびその瘢痕組織があります。
そのうちで、半数近くを占め、もっとも多いのが皮質形成異常です。
脳の表面にある大脳皮質は、胎児期に無数の神経細胞が脳の内部から移動してきて形成されます。この皮質が形成される過程において、狂いが生じ、その結果できあがった「出来そこないの」大脳皮質領域が皮質形成異常病変です。皮質形成異常のある皮質では、きちんとあるべき所に神経細胞がなく、神経細胞自体も異常です。神経細胞間のネットワークが乱れていて、異常電流が流れやすくなっています。良性腫瘍、血管腫などによるてんかんでは、腫瘍の圧迫によって周囲の神経細胞網が変形し電流が乱れやすくなっているためにてんかん発作が起きますが、皮質形成異常では、病変自体から異常放電が発生し、てんかん発作がもたらされます。
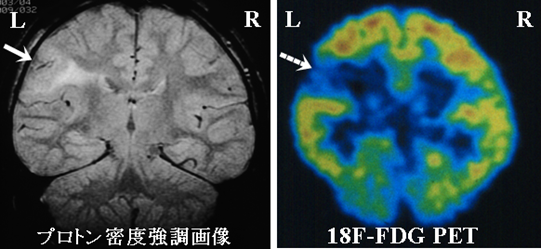
| 図18 症候性前頭葉てんかん 9歳男児 2歳頃からよく口唇をふるわせることに気づかれていた。4歳4か月から、顎をがくがくさせ、その後右上肢を挙上、口唇、顔面を震わせる発作が日に数十回頻発。発作時脳波で左半球に始まる律動波を認めた。MRIプロトン強調画像(左図)で前頭葉の皮質-白質に異常信号(矢印)を認め、ポジトロンCT(右図)で同部位のブドウ糖の取り込みが低下(破線矢印)していた。切除術が行われ、切除標本には皮質形成不全が認められた。 |
「器質病変が検出された部分てんかん」では、内側側頭葉をのぞいた大脳皮質、すなわち、側頭葉の外側、前頭葉、頭頂葉、後頭葉のいずれからでも発作が起こりえます。発作も各々の皮質のさまざまな機能を反映した症状がみられますから、当然、発作症状も内側側頭葉てんかんのように定型的ではなく、多彩です。
「器質病変が検出された部分てんかん」では、画像検査(多くは、高解像度のMRI)によっててんかん発作の原因と推定される病変が確認できます。しかし、MRIでみえているその病変をすべて手術でとってしまえば、発作が止まるのかというと、そんなにうまく事は進みません。
たとえば、皮質形成異常では、病変そのものがてんかん焦点になりますが、MRIで異常所見としてみえている皮質部分だけ がてんかん焦点であって、それさえとってしまえば発作が止まるのかといいますと、そうとは限りません。MRIは素晴らしい画像検査ですが、それでも、限界があります。MRIは形態異常を検出する手段にすぎず、異常電流が流れやすい部位をみせてくれるわけではありません。ましてや、病変周囲の皮質の細かな機能を手に取るように描出してくれるわけでもありません。機能性MRI、ポジトロンCT、SPECTといった脳の機能を表示する画像検査もありますが、それらとて、てんかん焦点と皮質機能を正確に示してはくれません。このため、頭蓋内の皮質表面に電極をおいたり(硬膜下電極)、脳に電極を差し込んだりして、てんかん焦点の広がりを確定する必要があります。
また、てんかん焦点を切除した場合に重大な機能欠落が生じないか確認するために、そうした頭蓋内電極によって、てんかん焦点およびその周囲の脳機能を評価する必要もあります。
だいたい3週間ぐらい、頭蓋内に電極を設置して、ビデオ脳波同時記録によって発作のとき実際にはどこから異常電流がはじまり、どのように伝搬していくのかを確認します。
その一方で、頭蓋内電極を使って脳を刺激し、てんかん焦点およびその周囲の皮質機能を確認します。とくに、言葉、体の動きなどの重要な機能を司る皮質と切除すべき皮質が重なっていないかどうかを、はっきりさせます。忍耐を要する検査ですが、皮質切除によって発作消失と機能脱落阻止を両立させるためには、是非とも必要な検査です。
そうやって、切除すべきてんかん焦点の範囲を決めます。
発作を完全に止めようと思えば、画像でみえる病変部位、そして、頭蓋内電極で確認されたてんかん焦点とその周囲をできるだけ多く切り取る方が当然いいのですが、いつもそれができるとは限りません。患者さん、患者さんの家族にもデータをすべてお示しし、時間をかけてご説明して、ご意見をうかがうことになります。
一般的に、画像上の病変が小さければ、てんかん焦点も小さいはずですから、重要な皮質機能と重なっている可能性も低く、外科治療の予後もよくなります。内側側頭葉てんかんと同等、あるいは、それ以上の発作消失率さえ期待できます。
一方、病変が広いと、重要な機能を司る皮質がてんかん焦点に含まれる確率が高くなります。そうすると、てんかん焦点をすべて取り切ることができなくなってしまいます。そのようなときには、発作消失率も残念ながら50%を割ってしまいます。
視床下部過誤腫てんかん
病変が分かっていてもてんかん焦点をうまく取り除くことができない特殊なてんかん性疾患に視床下部過誤腫があります。過誤腫という名前がついていますが、どんどん膨らんでいく腫瘍ではありません。皮質形成異常と同じような先天異常で、大脳半球間の底部に位置する視床下部に連なる直径0.5cm~3cm(平均1.5cm)の膨らみです。過誤腫の内部には異常な神経細胞とグリア細胞が詰まっています。これらの異常細胞は受胎後間もなく発生すると考えられていて、脳の成長とともに大きくなります。しかし、周囲の脳を圧迫するほどに膨れあがることはありません。ですから、過誤腫があっても無症状のことも少なくありません。ところが、人によっては過誤腫と視床下部との相互作用によって思春期早発症やてんかんを発症することがあります。そして、それによってはじめて過誤腫の存在に気づかれます。ただし、1cm未満の小さいものだとよくよく気をつけてみないとMRIをとっても見過ごされることがあります。
思春期早発症は生殖刺激ホルモン放出ホルモンが思春期に入る前から放出され始めるために起きる病気で、女の子の場合、幼少時から乳房が膨らみ、陰毛、腋毛が生え、月経が始まることで気づかれます。しかし、男の子の場合、女の子同様身長の伸びは早いのですが、それ以外の特別な症状にはなかなか気づかれません。小さい頃は背が早く伸びていきますが、思春期に入る前に身長の伸びは止まってしまうために、最終身長は低く、低身長となります。これを防ぐために生殖腺刺激ホルモン放出ホルモンの働きを抑制する拮抗剤、リュープリンが投与されます。
視床下部過誤腫のてんかんの特徴は笑い発作です。突然、引きつった笑い顔になったり、笑い声をあげたりします。しかし、その笑いは、多くの場合、感情をともなわない、空虚な笑いです。笑っていても、目つきがボンヤリとしていることが多く、意識レベルが下がっているのかもしれません。しかし、数秒から数十秒でおさまると「終わった!」とおっしゃる患者さんもいて、ある程度発作を自覚しているようにもみえます。赤ちゃんの時から発症し、生まれてすぐから笑い発作の症状がみられる子は、もしかしたら、お母さんのお腹の中でも笑っていたのかもしれないといわれています。発作は一日に何度となく頻発することが多く、抗てんかん薬による抑制は困難です。この笑い発作は過誤腫内の異常神経細胞のてんかん性異常興奮によって生ずることが分かっていますが、時がたつにつれ、過誤腫から他の領域に異常電流が拡散、複雑部分発作、全身けいれんへと発展します。強直発作、非定型欠神、転倒発作が出現し、難治性レノックス・ガストー症候群の病像を呈することもあります。このてんかんの進展とともに、知能障害や行動異常があらわになることもあります。行動異常は激しい多動や手のつけられないパニックなどで、本人と周りの人々の生活がかき乱されます。
過誤腫は脳の真ん中底面、きわめて奥深いところにあるため、これを取り除く手術は困難をきわめます。上は内分泌機能、自律神経機能を統合する視床下部に直結し、周囲には記憶に関係する脳弓や視覚に関係する視索があるので、切除しようとしても、一つ間違えば、重大な合併症をきたす恐れがあります。昔は、それでも、直接とりにいく手術も行われていましたが、その後、内視鏡手術に取って代わられました。しかし、いずれの方法でも過誤腫と視床下部との境界が分かりづらく、過誤腫を完全に取り切れませんでした。MRIでみるとこの境界が分かることがあるので、コンピューターを使って狙いを定め、ガンマナイフで破壊する方法も試みられました。コバルトから放出される放射線の一種、ガンマ線を多方向から当てて標的組織を焼く方法です。しかし、いずれの方法でも発作消失率はせいぜい50%で、しかも、視床下部機能不全などの深刻な合併症を生ずることがありました。
最近、西新潟中央病院が行っている定位温熱凝固手術が8割台の発作消失を達成し、注目を浴びています。MRI画像をもとにコンピューターで位置を計測して狙いを定め、先端に70度台の熱を発するポイントがいくつもある細い針を複数差し込み、視床下部と過誤腫の境界部を熱で凝固させ、てんかん放電の伝導路を破断するのです。処置後、一時的な異常は出現するものの、永続的な手術後遺症がみられず、発作の消失にともない異常行動がおさまり、知的能力の改善も認められるという報告がなされています。
器質病変を認めない部分てんかん
難治てんかんの中には、発作症状、脳波所見、機能画像所見から特定の皮質を焦点とする部分てんかんが疑われるもののMRIで何度検索しても、それらしい病変がみつからないことがあります(ただし、MRIの解像度が高ければ検出率も高まります。現在、3T(テスラ:MRI撮像に使われる磁場の強さを表す単位)MRIが一般的ですが、10TのMRIですと、てんかんをもたらす病変の検出度が従来のMRIより数十%上昇すると報告されています)。
画像上で病変を特定できないこうした「潜因性」難治性部分てんかんでも、時として、皮質切除術が試みられます。
その場合、以前お話した方法を総動員しててんかん原性領域 epileptogenic zone の確定に努めます。
ただ、画像上の目標がありませんから、まず、発作症状を詳しくお聞きして焦点を推定し、さらに、発作時のビデオ脳波同時記録で発作焦点候補部位を狭めていきます。また、SPECTで発作時にどの部位で血流が増加するか確認します。血流が増大している部位が発作焦点である可能性が高いからです。さらに、ポジトロンCT(PET)や脳磁図(MEG)などあらゆる検査を総動員して、発作焦点の確定に努めます。こうしてある程度発作焦点が推定できるようになったところで、その発作焦点およびその周囲に硬膜下電極や深部電極を頭蓋内に設置し、発作時、異常放電が始まる皮質部位を特定します。さらに、発作焦点が疑われる皮質の周囲の皮質機能の情報も頭蓋内電極からの刺激によって集めます。発作焦点とその周囲を切除しても重大な機能喪失をきたさないか知るためです。
しかし、これほどの苦労を重ねても、器質病変を認めない部分てんかんにたいする外科治療の成績は、残念ながら、あまり芳しいものではありません。いまのところ、発作が完全に消失する可能性は50%に達していません。しかし、それでも、難治てんかん発作に悩まされ、苦しんでいる患者さんにとっては、条件がそろえば、考慮すべき治療法の一つでしょう。
ちなみに、発作が消失した患者さんの切除した脳の切片でみられる病理変化のほとんどはグリオーシスなどの軽微な変化です。軽い傷跡ぐらいに考えていただければいいかもしれません。皮質形成異常や硬化性変化はほんの一部でみられるだけで、はっきりした異常が全くみつからないこともめずらしくありません。
一側半球の広範な病変による部分てんかん
今までお話してきたてんかん外科治療は限局したてんかん焦点を対象としたものです。切除するのは脳のほんの一部です。しかし、てんかんをもたらす疾患のなかには、病変が広範にわたったり、脳のさまざまな部位に散在していることがあります。そのような広い範囲の病変の疾患としては片側けいれんー片側麻痺ーてんかん(Hemiconvulsion-Hemiparesis-Epilepsy (HHE))症候群、片側巨脳症、広範皮質形成異常、Sturge-Weber症候群、Rasmussen症候群、そして、結節硬化症があります。こうした疾患では、てんかん発作を止めるために、大脳皮質を広い範囲にわたって切り取る必要があります。ときには、片側の大脳半球すべてを切り取らなくてはならないこともあります。もちろん、そんなことをすれば、普通でしたら、運動麻痺、言語障害など重大な合併症がもたらされます。
ところが、そうした重大な機能脱落をあまり気にする必要がないことがあります。
成長過程にある幼い子たちです。
未熟な脳は柔軟性に富んでいて、一部の脳が機能異常をきたしても、他の部位がその機能を代償してくれることがあります。発作が頻回に起きているてんかん焦点周囲の皮質の機能を、たとえば、反対側の健常な大脳半球が肩代わりしてくれているかもしれないのです。むしろ、てんかん発作を盛んに起こしている広範な皮質領域、あるいは、大脳半球は、健側のそうした代償性機能を阻害している可能性さえあります。
もちろん、これは、あくまでも、理論上の仮説にすぎません。
ところが、この仮説が見事に証明される例が少なくないことがわかってきました。広範囲にわたる皮質切除、あるいは、半球切除によって、発作が止まり、重大な機能障害は生じず、むしろ、運動機能、知的機能が向上する小児難治てんかん例が報告されてきているのです。
ただし、これは成長期の子に限った話です。また、術後、軽い麻痺などがみられるようになる子もいないわけではありません。それに、脳に広範な病変がある子ですと、もともと、運動面でも知的な面でも問題を抱えていることが少なくありません。そうした子の場合、発作が止まったからといって、それまでみられていた精神運動発達の遅れが全く消失するわけではありません。しかし、それでも、全体としてみると、発作消失に連動して、運動面でも知能面でも改善し、生活の質のレベルが上がることが結構あります(少なくとも、激烈な難治発作が持続するよりは精神運動予後が勝ります)。
大脳半球は、前頭葉、側頭葉、頭頂葉、後頭葉の4つからなっていますが、今まで述べてきた切除外科では、内側側頭葉てんかんのように、側頭葉のほんの一部を切り取るだけです。しかし、ここで述べている広範な病変による部分てんかんでは、側頭葉と後頭葉といった具合に、2つ以上の脳葉にまたがっててんかん焦点と目される皮質を切り取ることになります。そして、片側巨脳症のように、一側の大脳半球のほとんどが異常皮質で覆われていて、そのどこからでも異常放電が発生しうる疾患の場合には、異常大脳半球をすべて切り取ることもあります。実際、昔は、一側の大脳半球をまるまる切除する手術も行われていました。しかし、これは、とても大がかりな手術で、ヘモジデローシスといったやっかいな、ときとして致命的な合併症も少なくありませんでした。そこで最近では、異常大脳半球との繊維連絡をすべて切断し、機能的にみるならば、一側大脳半球を切り取ったのと同等にしてしまう手術が行われています。これを機能的半球切除術といいます。
対象を選んで、きちんとした評価のもとに行われると、広範な皮質切除、あるいは、機能的半球切除術によって70%以上の患者さんで発作が消失します。そして、発作が止まるとともに、運動機能、知的機能の改善、生活の質の向上も少なからず観察されます。保護者の方の介護負担も大幅に軽減します。
とくに、Rasmussen症候群のように脳萎縮が徐々に進み、運動機能が進行性に悪化していく疾患においては、時機を逸せず広範囲の皮質切除をすることが推奨されています。
失立発作をもつ難治てんかん
失立発作というのは、立っていて突然倒れる発作の総称です。転倒の原因となる発作型としては、てんかん性スパズム、強直発作、ミオクロニー発作、脱力発作があります。レノックス・ガストー症候群といった症候性全般てんかんの患者さんなどにみられるやっかいな発作です。予告もなしに突然倒れるので、頭や顔を壁や床にぶつけ、生傷が絶えません。薬ではコントロールできない難治発作のことが多いので、けがの予防のためにヘルメットをかぶっていただくのですが、ヘルメットではカバーしきれなくて、歯を折ったり、目の周りや鼻をぶつけ、皮下出血をきたすことがまれならずみられます。まれには、眼球そのものが傷つくことさえあります。こうした失立発作に対して行われるのが脳梁離断術です。
脳梁というのは左右の大脳半球をつなぐ神経線維(交連線維)の束です(図19)。左右大脳半球の間に位置して、約2億本の交連線維が左右の大脳半球の情報伝達を担っています。
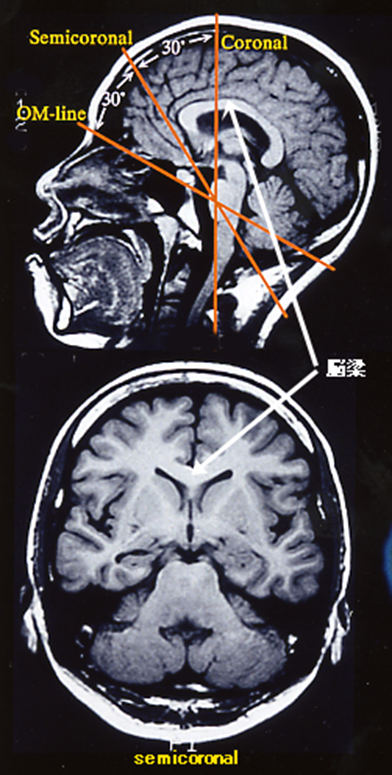
| 図19 脳梁 |
ところが、左右いずれかの大脳半球に異常電流(てんかん発射)が発生した場合、脳梁はその異常電流の伝達路にもなってしまいます。しかし、もし、脳梁という左右大脳半球の連絡路を断ち切ることができれば、理論上、異常電流の伝達も阻止されるはずです。そうなれば、てんかん発作の程度を軽くすることができるかもしれません。実際、動物実験ではそのような事実が確認されています。また、ヒトでも、この理論を裏付けするような現象が観察されています。脳梁に腫瘍が浸潤した途端、てんかん発作が消失した脳腫瘍の例が報告されているのです。
こうした事実を踏まえ、難治てんかんに対する治療として行われるようになったのが脳梁離断術です。
失立発作のみならず、難治前頭葉てんかんにも行われたこともあり、かつて、この術式はてんかん外科の10%近くを占めました。
しかし、その後、期待したほどの効果が得られないことがわかってきました。
部分発作やミオクロニー発作に対してはむしろ悪化させる可能性さえ指摘されるようになっています。ミオクロニー発作以外の全般発作についてもあまり有効でないことがわかってきました。
この術式で期待された痙攣重積傾向のあるてんかんに対しても結果は思わしくありません。
結局、今では、失立発作を主体とするほんの限られた難治てんかんに対してのみ適応があるとみなされるようになっています。
てんかん発作の源となるてんかん焦点をとってしまうわけではありませんから、脳梁離断のみでは、発作の完全消失は期待できません。発作の完全消失は5-7%にみられるだけです。原理的に発作の完全抑制が無理なわけですから、脳梁離断の手術成績は50%以上の発作抑制を指標として評価すべきという意見もだされています。実際、その程度の発作減少ならば、失立発作を有する患者さんの70-100%で達成可能と報告されています。ただし、2年ぐらいたつと、一旦減った発作が再び増えることがあります。しかし、その場合でも、術前のレベルまで発作頻度が戻ってしまうことはないようです。
ただし、失立発作以外の発作型については50%の発作抑制でさえ、35%から80%の患者さんにみられる程度です。これでは、脳梁離断という侵襲的な治療に見合わない結果といわざるをえません。したがって、失立発作以外での適応はあまりないということになります。
脳梁離断では、さまざまな合併症が起こりえます。手術後すぐにみられる急性期合併症としては、片麻痺があります。これは、手術の際、大脳半球内側の一部が引っ張られたり、静脈の流れが悪くなったりすることが原因と推定されています。さらには、大脳の前方にある脳動脈の攣縮によると思われる無言無動症がみられることもあります。しかし、こうした症状はいずれも一過性です。
まれですが、急性期の合併症として、硬膜外血腫もあります。この場合にはどんどん状態が悪化していきますから、緊急の対応を要します。
慢性期の合併症としては、まず、言語障害があります。言葉を操る言語野は左右いずれかの半球に偏在していることが多いのですが、一部の方では、両側半球いずれにも言語野があって、互いに協力し合って言語機能を発揮しています。そうした方に左右の大脳半球のつながりを断つ脳梁離断を行うと、言語機能を十分発揮できなくなってしまうのです。これ以外にも、左右大脳半球の情報が共有されないと生ずる微細な症状(たとえば、言葉で言われたことを左手でうまく行えないパントマイム失行など)が理論的には生じ得ます。しかし、やはり一過性で、生活に支障をきたすほどではないとされています。
迷走神経刺激法(Vagus Nerve Stimulation:VNS)
しかし、最近では、レノックス・ガストー症候群などでみられる難治性発作に対する治療法としては、脳梁離断よりも迷走神経刺激法の方が脚光を浴びるようになっていて、脳梁離断とは比べものにならない数の患者さんで行われるようになっています。同じ外科的手技を必要とする治療法ですが、脳梁離断に比べ、圧倒的に侵襲性が低いことがその理由の一つです。
迷走神経は脳の根元にある脳幹から伸び出て、咽頭、喉頭、心臓、肺、胃、腸など首、胸、お腹のさまざまな臓器に枝を出す恐ろしく長い、複雑な、込み入った末梢神経です。首からお腹にかけて長い距離を走行しながら、主立ったものだけでも30以上に枝分かれし、長いだけでなく、その走行が複雑怪奇で、まるで、体の中を彷徨って (vagus:ラテン語) いるようにみえるため、迷走神経(vagus nerve)と呼ばれています。
迷走神経は自律神経の一つです。
自律神経は胃や腸や心臓などの内臓や血管、分泌腺を調節する末梢神経で、交感神経と副交感神経があります。大雑把に言うと、交感神経は体を活発化させ、副交感神経は体を休憩させます。たとえば、交感神経は何かしようとするときに脈拍を増やし血圧を上げますが、副交感神経は休憩時、脈を落ち着かせ血圧の上昇を抑え、体が休んでいる時を狙って消化管や唾液腺などの活動を高めます。
迷走神経は副交感神経系の末梢神経で、呼吸、血液循環、体温、消化、排泄、生殖、免疫機能を調整しています。脳からの指令を内臓平滑筋などに伝える遠心性神経と、逆に、内臓の感覚受容体の信号を伝える求心性神経が迷走神経にはあって、この両方向の信号を伝達することによって内臓や血管や分泌腺の機能を調整しています。つまり、迷走神経には脳から内臓、血管、分泌腺をコントロールする末梢に向かっての信号(遠心性信号)のみならず、脳の末端に位置する脳幹に向かっての信号(求心性信号)も通過しているわけです。遠心性信号を伝える神経線維が20%、求心性信号を伝える神経線維が80%という構成になっています。この求心性信号は頸部の神経節に集められ、そこから発した信号は脳幹の孤束核に一旦集められます。この求心性信号は内臓などの感覚を伝えるのですが、その一方で、孤束核から視床を通じて皮質全体にも信号を伝え、皮質活動を変化させる神経変調作用Neuromodulationも有しています。このため迷走神経を「脳のペースメーカー」と呼ぶ人もいます。迷走神経のこの方面における機能を利用するのが迷走神経刺激で、てんかんに加え、抑うつ症状や頭痛にも効き目があることがわかっています。
| 図20 中枢神経と末梢神経の構成 |
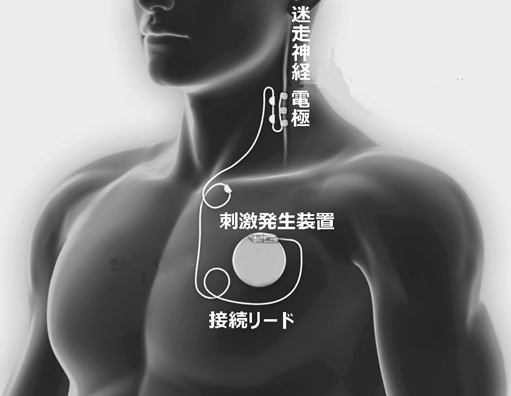
| 図21 迷走神経刺激 左胸の皮下に埋め込まれた刺激発生装置が0.25~3.5 mA、1~30 Hzのパルス電流を発生し、左頸部を通過する迷走神経を刺激する。 Hernán FJ et al. (2019 ) Vagus nerve Stimulation for the treatment of epilepsy Neurosurg Clin N Am 30: 219–230 改変 |
てんかんに関連していうと、動物の迷走神経を刺激すると脳波に変化が生じ、てんかん波が減少することがずいぶん前からわかっていました。さらに、迷走神経を刺激すると実際にてんかん発作が減少することも、動物実験でかなり以前から知られていました。
しかし、ヒトのてんかん治療として迷走神経刺激法が行われ、発作軽減効果が確かめられたのは1988年のことでした。
最初は部分発作での有効例が報告されましたが、その後、レノックス・ガストー症候群の難治発作などにも有効であることがわかってきました。発作頻度のみならず、発作持続時間を短縮する効果も確認されています。その上、一部の患者さんでは、発作がさほど減っていなくでも、迷走神経刺激によって覚醒度合いが高まり、記憶、決定能力などの高次脳機能が向上、学習意欲も改善し、生活の質が高まることも知られるようなってきました。さらに、気分が安定し、異常行動も減少することがわかってきて、このため、アメリカなどではうつ病の治療にも用いられるようになってきています。
しかし、なぜ、迷走神経刺激法によってそのような効果がみられるのか、さまざまな説が提唱されていますが、いまだに確かなことはわかっていません。
さらに、どんな患者さんによく効くのかも、じつは、まだ、よく分かっていません。発作型としては、当初、部分発作が対象でしたが、その後、強直発作、脱力発作などいろいろな発作にも効くことが分かってきています。成人に比べ小児で有効率が高いという報告もありますが、これもまだ最終結論がでていません。前もって、これならば効くはずだと対象を絞り込むことは、いまのところできません。出たとこ勝負で、難治てんかんであれば、とにかくやってみるしかないのが現状です。
迷走神経刺激法の具体的な手技としては、まず、首の側面の皮膚を切開して首の左側に走行している迷走神経を剥離して露出させ(これが手術の一番のポイントで、時間も要します)、螺旋状に電極を巻き付けます。そして、左胸の皮下に埋め込んだ電気刺激発生装置(パルス・ジェネレーター)(電池で作動)から電極に間欠的な微弱なパルス電流(0.25~3.5 mA、1~30 Hz)を送り込んで迷走神経を刺激します。最終的には、3~10分ごとに30~60秒間電気刺激をすることになります。刺激電流の大半は脳に向かって昇っていき、なるべく、内臓には向かって下っていかないよう、電極には工夫が凝らされています。
手術に要する時間は約2時間です。電池の寿命は約8年で、寿命が尽きそうになると、局所麻酔をして刺激装置を付け替える約30分程度の小手術が必要になります。
日本では、てんかん外科の経験を十分に積んでいるてんかん専門外科医が、研修を受けたのち電極設置を行うことになっています。ただし、電極設置後の刺激条件(電流強度、刺激パルスの周波数、持続時間など)の調整、経過観察は、研修を受けた外科医以外のてんかん専門医も行うことができます。
てんかん発作に有効といっても、脳梁離断術と同じで、切除術のような劇的効果は期待できません。23 – 57%の患者さんで、50%以上の発作頻度減少がみられる程度です。完全な発作消失はせいぜい8%程度です。ただ、月日がたつと有効率が高まるかもしれないことは知っておいて下さい。最初はあまり効いていないようにみえても、月日を重ねるごとに発作が減っていくことがあるのです。これについては異論もありますが、少なくとも、耐えがたい副作用がないのであれば、すぐにはあきらめず、気長に待ってみる価値はあるかもしれません。
新しい治療法ですので、迷走神経刺激は進化の途上にあります。たとえば、動悸などの発作の前兆を患者さんが感じたときなど、これに対応できるようになってきています。上で述べたように迷走神経刺激は間歇的に時間をおいて行われるため、刺激していない時間が結構あるのですが、刺激していない間にも、あやしいと思ったら、患者さんや保護者の方が、携帯用マグネット(Wand:魔法棒)を刺激装置の上に一瞬当てて刺激を開始し、発作をくい止められるようになってきているのです(このマグネットを胸に当て続けると、今度は、刺激がとまります)。しかし、いつもうまくいくとは限りません。そこで、現在、前もって設定しておいて、心拍があがると(通常100/分以上)、自動的に刺激を始めることもできるようにする方法も考案されています。さらに、脳波を常時モニターし、発作が始まったら刺激を開始する装置も考案され、アメリカなどでは実用化されつつあります。手術をせずに迷走神経を刺激する方法も開発中です。耳たぶに電極をおいて、迷走神経の耳介枝から刺激するやり方が考えられているのです。
脳梁離断術に比べれば侵襲度が桁違いに低いですが、手術というからには迷走神経刺激術にもある程度の危険はあります。手術野の血腫、感染、それから、声帯麻痺をきたすことがあります。しかし、重大なものはほとんどありません。一番多くて(2.6%)困るのが手術創の感染で、抗生物質でなんとかなることもありますが、どうにもならず、刺激電極を抜去せざるをえなくなることもあります。よだれで首をべとべとに汚してしまう小さい子の場合、とくに問題です。
迷走神経に対する電気刺激を開始してからの副作用としては、嗄声がもっとも多くみられます。声帯を制御している反回神経が迷走神経のそばを走っているために、巻き添えを食らって電気刺激され、これが声帯の動きに変調をきたすために起こると考えられています。迷走神経のそばの感覚神経を刺激してしまうために喉の痛みがでることもあります。しかし、発作とは逆に、こうした副作用は時間の経過とともに症状が軽減する傾向があります。嗄声は術後すぐには30%近くの人にみられますが、3年たつと2%にまで減少することがわかっています。迷走神経の刺激による徐脈、心拍停止も全くみられないわけではありませんが、きわめてまれです(1000人の患者で0.06回)。これは前に述べたように、迷走神経に加えられた電気刺激の大半は首から上に向かい、下に向かって内臓に到達する電流は少ないためだと考えられます。無呼吸などの呼吸への影響もないわけではないですが、無視できる程度のものです。通常のてんかんの方にきわめて稀にみられる突然死と比較して、迷走神経刺激施行例の突然死の頻度が特に高くないことから、迷走神経刺激による死亡例は実質的にゼロと考えられています。
さらに、副作用症状が現れたら、刺激を低減したり、一旦中止したりすることで対応できます。また、先程も言いましたように、発作に対する効果はさほどでもないのに、覚醒度が上がったりして生活全般にいい影響を及ぼしたりすることもあります。こうしたことから、多くの患者さん(および、保護者の方)が迷走神経刺激の継続を望まれます。
切除術ほど有効率が高くありませんから、迷走神経刺激は外科治療やケトン食療法による発作抑制ができない難治てんかんに対する補助療法という位置づけです。しかし、それでも、レノックス・ガストー症候群のように、薬による発作抑制が難しい患者さんには朗報といえるでしょう。脳梁離断よりも侵襲性が圧倒的に少ないですし、副作用が出れば、電気刺激を弱めることによって、簡単に調整できます。そして、無効とわかれば刺激電極と刺激装置を外して元通りに戻すこともできます。これに対し、脳梁離断では、一度切り離してしまった神経線維結合を元に戻すことはできません。こうしたことを考えると、脳梁離断前に考慮すべき治療法といっていいかもしれません。
脳深部刺激療法Deep brain stimulation (DBS)
頭蓋内に差し込んだ電極で脳の特定の部位を電気刺激する治療法です。脳が何らかの機能を発揮する場合、脳内の複数の部位がつながったループを介することに着目し、ループ内の特定部位を電気刺激して神経機能を変調modulateし、治療につなげる方法です。難治パーキンソン病やジストニアなどの不随意運動に対する脳深部刺激療法DBSの有効性はかなり前から確認され、日本でも保険適用がなされてきましたが、最近、難治てんかんに対して視床の前方にある記憶に関連する辺縁系回路の一つである視床前核を刺激するDBSも認可されました。迷走神経刺激VNSと同じように胸部の皮下に電気パルスを発生する埋め込み型刺激装置を装着し、皮下を通る延長リード線を介して視床前核に留置された電極が視床前核神経細胞を電気刺激する仕組みになっています。アメリカからは50%以上の 発作減少率が3か月で40.4%、2年で56%、5年で69%と報告されていて、VNS同様、日を重ねるごとに効果を発揮するようになるようです。5年目での発作減少率50%のVNSに比べると有効率は高いのですが、頸部の迷走神経への手術に比べ、脳内の電極挿入は侵襲度が強いので、まずは、VNSを行い、それで思わしい結果が得られない場合、あるいは、許容できない副反応がみられたとき選択されるようになるものと予測されます。DBSの副反応としては記憶障害、うつ症状などが10-20%みられます。
正常であることの重荷(Burden of normality)、よくなったことの重荷(Burden of Wellness)
このように、さまざまな外科的手法によって、薬物抵抗性てんかんに向き合うことができるようになってきました。このうち、切除術によって、長年つきまとってきたてんかん発作から解放される方は少なくありません。まさしく解放されるのであって、発作が突然なくなり、四六時中身構える必要がなくなった晴れ晴れとした気持ちを患者さんたちは異口同音に口にされます。
しかし、それでは、それで、めでたし、めでたしかといいますと、残念ながら、そうはいかないことがあります。
外科的治療を受けられる方の多くは、長年、意識を失う発作を繰り返してきています。そして、そうした発作に耐えるために、どうやら、肉体的、精神的な防御反応を身につけられているようです。ところが、その発作が、突然、消失します。長年にわたって身につけた防御反応が、発作という目標を失い「身を持て余します」ようになります。
さらには、発作があるということで周囲から大目にみられてきたことも許されなくなります。
こうしたことが重なるためでしょう、発作が消失したというのに、手術後、さまざまな精神症状に悩まされる患者さんがみえます。
一番多いのが抑うつ症状です。せっかく発作が止まったのに、気分はかえって沈み込んでしまい、中には、自殺を考え、実際に実行してしまう方までいます。さらに、言いしれぬ不安、幻覚、妄想に苛まされる方も少なくありません。とくに、年齢がいってから手術を受けた方に多いようです。
こうした精神症状にきちんと対処する必要があるのはいうまでもありません。放置すれば、発作が止まって、明るく輝くべき患者さんの将来が暗転してしまいます。
外科治療によって発作が止まるのは事実です。しかし、残念ながら、手術はいつも「幸せの魔法の杖」だとはいえないのです。日本てんかん学会の元理事長、八木先生がおっしゃってみえるように、発作がなくなったからといって、すぐに歩き出せないかもしれません。正常であることの重荷(Burden of normality)、よくなったことの重荷(Burden of Wellness)が顕在化することがあります。発作がなくなったあとも、家族、医療、福祉が見守る必要があります。発作が止まったあとも、支え続けることが大切です。
あまりに少なく、あまりに遅い
てんかん外科については、もう一つ、問題があります。
てんかん外科の対象となる患者さんはかなりいるはずなのに、そうした患者さんのほとんどが、てんかん外科を行っているてんかん基幹病院に相談にも訪れていないことです。しかも、相談に訪れるにしても、あまりに遅いのです。このために、外科治療によって発作が停止し、いい生活を送ることができるはずの患者さんが、みすみす、その機会を逃してしまっています。
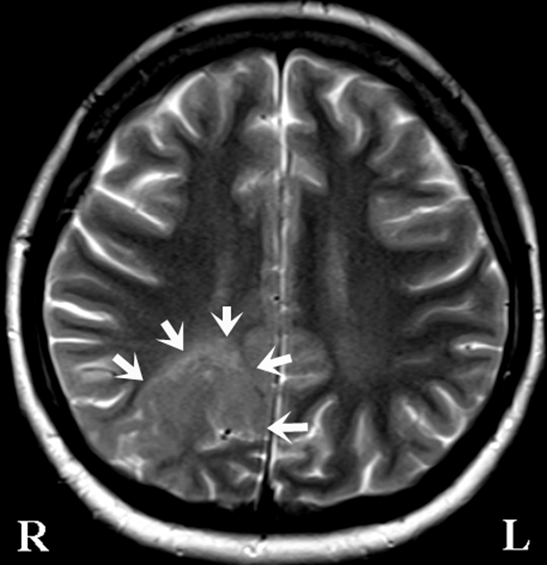
| 図22 右後頭-頭頂葉皮質形成異常(矢印) 34歳女性 生後2か月 顔を左に向け,激しく瞬きし、右上肢屈曲硬直、その後、全身が硬直する10秒から数十秒の発作が出現。治療にもかかわらず発作頻度が増え,1日100回に達することもあった。3歳のとき、てんかんセンターに入院したが発作はコントロールされなかった。その後、手術を勧められたが、兄弟もいて、もうこれ以上母親が付き添っての入院はできないと断念。中学生までは歩いていたが,その後、徐々に運動機能が失われ、寝たきりになってしまった。言葉もみられなくなった。33歳のときペランパネルなどを併用することによって、1日10-40回あった発作が、1日0-5回にまで激減したが、運動機能、知的機能の回復はほとんどみられなかった。 |
薬剤抵抗性てんかんの少なくとも10%はてんかん外科の対象と試算されていますが(50%以上という試算もあります)、たとえば、アメリカでは、薬剤抵抗性てんかんの1%しか人員、設備の整ったてんかん基幹病院に受診していないと推定されています。さらに、てんかん発症から手術までの期間が平均20年以上という結果がでています。これでは、てんかん外科で発作が止まっても、難治発作によって生じた精神運動発達の遅れは残ってしまいます(図22参照)し、その間の社会生活上の不利益は戻ってきません。
基幹病院に訪れていないためにてんかん患者さんの早死(premature death)の危険性が高止まりしている可能性も指摘されています。
てんかんの患者さんの中には、きわめてまれですが、予期せぬ突然死(Sudden Unexpected death in epilepsy (SUDEP))がみられることがあります。てんかん発作に伴う外傷や溺水が原因ではなく、検死でも死因が明らかにできない、突然の、予期せぬ、てんかん患者さんの死亡事例のことをいいます。死亡したときの目撃者の有無、てんかん発作の有無は問わないことになっていますが、その定義を当てはめると、年間1,000人に1~2人がSUDEPで亡くなっていると推定されています。頻発発作、痙攣発作(とくに全般性強直間代発作)、男性、若年てんかん発症、長期にわたるてんかん罹病期間、複数の抗てんかん薬服用がSUDEPの危険因子とされています。いうまでもなく、薬剤抵抗性てんかんの患者さんはこれらの危険因子をいくつも併せ持っているわけで、SUDEPをきたす危険性が高いことがわかります。なぜSUDEPが起こるのかは今のところよくわかっていませんが、痙攣後の急性心不全、呼吸不全、脳機能不全などが何らかの形で関与しているかもしれないと推定されています。このSUDEPによる死亡は、てんかん外科治療後には、発作が完全に止まっていなくても、減少することが分かっています(Sperling MR et al 2016)。
このように、外科治療は薬剤抵抗性てんかん患者さんの早死を回避し、生活の質を向上させる可能性があります。にもかかわらず、アメリカでは外科治療を行っているてんかん基幹病院にてんかん外科対象の10分の1以下の方たちしか紹介されておらず、しかも、ようやく紹介されてきても、あまりにも遅いのです。その理由のひとつは、患者さんとその家族のみならず、てんかんの診療にあたる医師がてんかん外科のことをきちんと認識しておらず、てんかん外科が魅力的な治療法にみえていないのではないか、とEngelは疑っています。神経科医でさえもがてんかんの外科治療にかんして様々な点で誤った捉え方をしているのというのです(表)。この「曲解」とでもいうべきものを訂正するのはもはや絶望的で、したがって、てんかん外科を勧めるのではなく、まずは、薬剤抵抗性てんかんの再評価をてんかんの基幹病院に受診するようにしてはどうか、とエンゲルは提案しています。前にも言いましたが、薬剤抵抗性てんかんの少なからぬ患者さんが実際にはてんかん発作を有していないことがあると報告されています。もし、てんかんでないのであれば、他の治療、対処方法で患者さんの生活環境が改善する可能性があります。一方、本当にてんかんであっても、その発作型、てんかん症候群が適切に診断されていなくて、間違った治療が行われている可能性もあります。ですから、とりあえず、てんかん発作の再評価のためにてんかん基幹病院に受診することを呼びかけてはどうか、とエンゲルはいうのです。さらに、てんかん基幹病院にはてんかん患者さんが日常生活で遭遇する問題とその対処方法を分かっている精神科医、心理士、カウンセラー、ソーシャルワーカーが控えています。発作がコントロールできるかどうかはともかく、発作以外のさまざまな問題に対処してもらえるだけでも基幹病院を受診する価値はあるはずだ、というのがエンゲルの考えです。
| 表10 てんかん外科治療にかんする誤解 | |
| 間違い | 正解 |
| ・ とにかく、抗てんかん薬をすべて試すべきだ。 ・ 脳波上、両側に棘波がみられると外科治療はできない。 ・ MRIが正常な症例は外科治療ができない。 ・ MRIで多発病変、あるいは、広汎性病変がみられる例ではてんかん外科治療は禁忌だ。 ・ 一次運動野、一次感覚野などがてんかん焦点に含まれていると外科治療はできない。 ・ 記憶障害のある例では手術が記憶力をさらに低下させる。 ・ 慢性精神病があるとてんかん外科治療はできない。 ・ 知能指数70以下はてんかん外科の適応外である。 ・ 部分てんかんがあり、局在病変のある患者では、術前、てんかん外科は十分に調べずに無造作に局在病変を取り除いてしまう。 ・ てんかん外科をやるには年をとりすぎている。 | ・ 適切な抗てんかん薬を2種類試してだめなら、次の薬で発作がコントロールできる可能性はきわめて低い。 ・ 片側半球から発作が始まる患者で、両側に棘波がみられることはめずらしくない。 ・ MRIが正常でも他の方法で単一てんかん焦点を検出できることがある。 ・ てんかん焦点は一つの病変の中にだけ隠れていることがある。 ・ 重要機能が局在している皮質を特定し、切除対象から除外することができる。 ・ 手術で記憶障害が悪化することは通常なく、むしろ、改善する可能性がある。 ・ 精神病があっても、発作が消失すれば、患者にとっては利益となる。 ・ 予後は発作型と手術手技により決まる。知能障害があることは問題とならない。 ・ 局在病変はてんかんとは無関係の偶然の所見ということもありうる。局在病変にてんかん原性があるかどうかはつねに確認する。 ・ 年をとっていても若者同様てんかん外科治療はうまくいく。 |
| Engel JJ (2011) | |
エンゲルが提起している問題が日本ではどうなっているのか、きちんとしたデータはありません。しかし、おそらく、アメリカ以上に薬剤抵抗性てんかん患者さんが基幹病院に紹介される機会が少ないのではないかと思われます。あとで述べますように、ロボトミー騒動の影響で日本のてんかん外科治療は欧米にくらべ出遅れました。日本てんかん外科学会のホームページ(http://plaza.umin.ac.jp/~jess/field.html 2022年3月21日閲覧)を見ると
「我が国でのてんかん外科の年間の手術数は2005年から2010年まで486、620、600、553、595件と少しずつ増加している。しかし、この数字は欧米の統計から人口割で推定すると、年間3000件の手術が必要と考えられるが、実際には500件程度であり、いまだ手術できていない症例が多く存在しているようである」
と書かれています。こうした現状に対し2010年以降、てんかん外科も含むてんかん診療の拠点を各都道府県で立ち上げる試みが日本ではなされてきています。しかし、まだまだ、欧米には追いついていないと想像されます。このことから、欧米以上に日本では薬剤抵抗性てんかんの患者さんが十分に再評価されず、てんかん発作以外にかんする生活支援もなされておらず、てんかん外科治療も受けていないのではないかと懸念されます。
このように、てんかん外科はその有効性や安全対策が確立しているにもかかわらず、想定対象の10分の1の患者さんにしか手術がなされていません。その理由としてEngelは患者さんとその家族のみならず、てんかんの診療にあたる医師がてんかん外科のことをきちんと認識しておらず、てんかん外科が魅力的な治療法にはみえていないのではないかと疑っています。
たしかに、「脳にメスを入れる」ことに疑惑の目を向け、拒否反応を示される患者さんや家族の方が今も少なくありません。しかし、その疑惑、拒否の裏には、Engelは触れていませんが、もしかしたら、一部、(とくに日本では)ロボトミーへの警戒心が隠れているのかもしれません。ロボトミーにまつわる暗い影が、同じく、脳を切断、切除するてんかん外科にも及んで、患者さんやご家族の(そして、一部医師さえの)逡巡を誘っているようにも思えるのです。
そこで、誤解を解くために、話が飛び、長くなってしまいますが、ロボトミー(精神外科)についてここで触れておきたいと思います。
精神外科
ロボトミーとは、統合失調症、不安神経症、うつ病などの精神病に対し、主として前頭葉から他の脳組織への神経結合を離断する手術です。脳血管造影を考案したポルトガルのモニス(通称、本名はAntónio Caetano de Abreu Freire de Resende)が外科医のリマとともに精神外科の名の下に1935年に開始した外科的治療法から発展した術式で、1930年代から1950年代にかけて世界中で盛んに行われました。
モニスとリマが最初に行ったのは、頭頂部に穴を開け、そこから前頭葉前野の白質にアルコールを注入して神経結合を裁ち切る手術で、前頭前野白質切截術 (Prefrontal Leukotomy)と名付けられました。第1例は不安に苦しむうつ病の女性で、一定の効果があったようです。その後、彼らはアルコールを注入するのではなく白質の神経線維を輪状の細い線で機械的に切断する術式 (白質切断leukotome) に切り替えます。そして、うつ病に加え、不安神経症、統合失調症へと対象疾患を拡大し、こうした外科的手技を精神外科と名付けました。その精神外科の結果ですが、「精神錯乱」症候群が少なからず軽快し、20例のうち、治癒7例、改善7例、変化なし6例で、知的機能異常や記憶障害は認められなかったという報告がなされています。疾病としてはうつ病、不安神経症への効果が良好で、統合失調症に対してはあまり思わしくなかったようです。しかし、これはあくまでも短期予後の報告で、生活の質も含めた総合的評価は十分にはなされていません。にもかかわらず、かれらは「前頭前野白質切截術は安全で簡単な手術で、一部の精神疾患に有効である」と報告しました。
手術結果がきちんとした検討されていなかったこともどうかと思いますが、それ以上に問題だったのは、手術の根拠です。切断した前頭葉白質に腫瘍とか出血とかいった病変があったわけではありません。かといって、てんかん外科治療の時のように、脳波異常などの機能異常が切断した神経繊維やその周囲の神経組織に確認されていたわけでもありません。根拠は理論的仮説だけだったようです。よく言われているのは、最初の手術が行われた前年に開催された学会での「強度行動障害」チンパンジーについての報告をヒントにしたというものです。マスターしきれない複雑なタスクを負荷され、泣きわめき、皿をひっくり返し、尿をまき散らすようになった「実験神経症」のメスのチンパンジー、ベッキーの前頭葉と辺縁系をつなぐ神経線維を切断したら、同じタスクを負荷されても驚くほどおとなしく物静かになったという報告にモニスはいたく感銘を受けたというのです(ただし、実際にはこの実験はその学会では発表されておらず、同じ年に出版された雑誌に論文として記載されていただけだったようです)。しかし、橳島によると、どうやら、これは、この実験を報告したアメリカの生理学者ジョン・フルトンが言いふらした伝説だったようです(実際、モニスたちはフルトンの論文を引用していません)。モニスは脳神経外科の大家ダンディーによる脳腫瘍の報告、てんかん外科の大家、ペンフィールドの大脳皮質電気刺激の報告、神経生理学者パブロフの条件反射の報告、神経病理学者カハールの神経接合に関する報告などを総合して独自の理論を構築した、というのが真相のようです(橳島(2012))。といっても、その内容は「精神が錯乱した者においては……細胞のつながりの群が固定している……それらの活動は病者の精神生活において支配的な、錯乱と固定された観念に結びついている(橳島(2012)訳)」という、あまり根拠のない仮説から組み立てられた理論にすぎませんでした。ところが、モニスは「これらの病者を直すには、われわれが主に前頭葉とつながると考える細胞のつながりの配列を破壊しなければならない」と考え、本当に「細胞のつながり」を切ってしまったのです。
この手術には当時でも批判がありました。たとえば、カナダのペンフィールドはモニスの手術では瘢痕と血管異常がもたらされる可能性があるので、その「傷跡」によって精神状態が変化したにすぎないのではないか、とコメントしています (Leblanc R (2019))。(その後、ペンフィールドは視床との関連が深いと考えられていた前頭葉の真ん中辺りに位置するブロードマン10野の皮質切除を精神疾患症例10例に行っていますが、てんかん発作の出現、精神症状の悪化など散々な結果に終わったようです。以後、かれは精神外科を一切行っておらず、精神外科に憎悪の念を抱き続けたとのことです)。また、後になって、日本のロボトミー事件において批判の矢面に立たされることになる臺弘は、その頃、海外文献を翻訳しては専門雑誌に投稿しており、モニスの白質切截術(リュウコトミー)の論文も翻訳して「こんなことが治療になるのだろうかと疑って、その理屈づけは荒唐無稽に思われた」とのことです(臺弘「誰が風をみたか」)。
しかし、貴族階級出身のモニスは30代の頃、政治家として活躍、ポルトガルの外務大臣となり、第一次世界大戦後のパリ講和会議ではポルトガル代表団の団長まで務めているようなエリートで、その一方で、脳血管造影を実用化し神経学に変革を起こした高名な医学者でもありました。61歳になったその老モニスが行ったということもあったのでしょう、モニスの理論は多くの臨床医に受け入れられ、同様の手術が世界各国で行われるようになります。そして、1949年、脳血管造影ではなく精神外科の創始者としてモニスはノーベル賞を受賞します。その頃は、メディアも好意的で、あるアメリカの雑誌は「この国は脳の損なわれた人々の集団を市民と見做してしまっていると」と憂慮を表明、そうした状態を改善する期待を抱かせる精神外科を称揚しました。
精神手術はそのアメリカでもっとも盛んに行われました。最大の推進者は病理学畑出身のフリーマンで、モニスの術式に変更を加え、頭頂部ではなく側頭部(こみかめ)(頬骨弓前端の4cm上)に穴を開け、金属のヘラを挿入して振り払うように動かし、前頭葉の白質神経線維を切断する術式をジェームス・ワッツとともに考案、これをロボトミー(lobe=脳葉+tomy=切断; 脳葉切断術)と名付けました。この術式(フリーマン・ワッツ標準前頭前野脳葉切断術)はアメリカのみならず世界中に広がり、ロボトミーは精神外科の代名詞になりました。フリーマンは、のちに局所麻酔下に上眼瞼奥の眼窩孔からアイスピックを小槌で打ち込んで白質神経線維を切断する経眼窩式ロボトミー(アイスピック・ロボトミー)を考案しています。ドリルで頭蓋骨に穴を開ける必要がないので手術時間が5分に短縮されましたし、何よりも手術室のない精神病院でも施行可能になりました。そのおかげもあってでしょう、フリーマンは1936年から1957年までの21年間に約3000例という膨大な数のロボトミーを行っています。対象は統合失調症、うつ病、神経症で、最初の200例では改善63%、無変化23%、悪化もしくは外科的合併症による死亡14%と報告されています。しかし、現実に患者さんの症状がどのようになったのか、具体的にはよくわかっていませんし、手術を行っていない対象症例との比較検討もなされていません。
ペンフィールド以外にもこのロボトミーは乱暴ではないかと批判する臨床家や研究者は他にもいました。これに対して、まず、手術の根拠ですが、これは、先程いったジョン・フルトンによるチンパンジーの実験結果が(モニスに対してはともかく)、アメリカを含め、世界各国では手術施行者を納得させていたようです。基礎医学的な実験を基盤とした臨床応用であると安心感を与えていたのかもしれません。さらに、フリーマンは認知機能の主座である前頭葉と情動機能を司る視床をつなぐ経路の異常によって感情によって支えられた思考が狂うことが精神疾患の原因であるという説を唱え、ロボトミーを正当化しました。しかし、いずれの説も、今に至っても、きちんと証明されていない仮説です。このような危うい仮説のもとに3000例もの人間の脳に手を加えたということでフリーマンはのちになって非難を浴びることになります。
手術の根拠以上に問題視されたのが術式でした。頭蓋骨の隙間からアイスピックを突っ込んで、脳そのものを直に見ることなく、手探りで白質を切断していたからです。このため、ペンフィールドが心配したように、アイスピックが通過する皮質、そして、かき回される白質にはひどい瘢痕と血管異常がもたらされることがありました。おそらく、そのことはフリーマン自身も自覚していただろうと考えられます(図15)。そこで、脳を直視下においての手術が提唱されました。まず、開頭し前頭葉の前部を切り取る手術が提唱され、前前頭葉切除術(ロベクトミー)と呼ばれました。さらに、てんかん外科手術のように皮質のみを切り取る脳回切除も行われました。ただし、ペンフィールドの例同様、こうした方式では症状の改善は余りみられなかったようです。
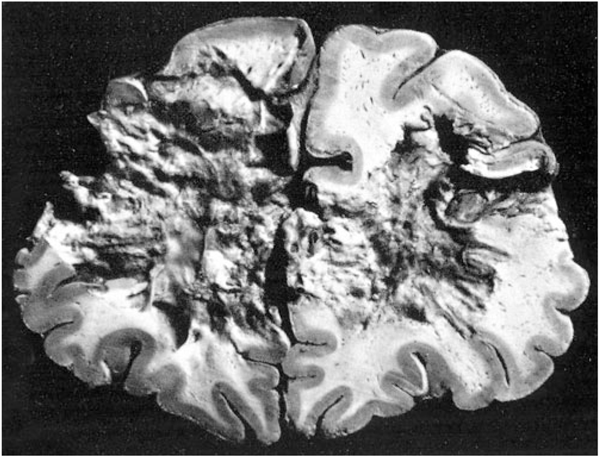
| 図15 フリーマンとワッツが行った前前頭葉ロボトミー後に死亡した患者の脳病理冠状像。ロボトミーの際に用いられた器具によって皮質と白質は破壊され空洞化している。(Lebanc R (2019)) |
そこで、現れたのが、例のスコヴィルのアンダーカッティングです。数㎝の穴を前頭骨に開け、直視下で脳に切開を加えたのです。これによって、正確に狙ったところを切り裂くことが可能となり、扁桃体と海馬も綺麗に切り取ることができました。それによってヘンリーの記憶が失われたわけですが、切除部位を慎重に選べば、ロボトミーに比べ副反応を軽減できると考えられていました。フリーマンほどではないですが、スコヴィルも300例とかなりの数の精神外科手術をこなしています。
精神科医からの依頼がそれだけ多かったのです。
「手術を受けるグループの用意ができたといってくるんだよ………精神病院につくと患者たちが待機させられていてね。こちらはチームを組んで手術をやったものだよ(フィリップ・ヒルツ著 竹内和世訳「記憶の亡霊」)」とスコヴィルは当時を回想しています。
このことは、疑いの目でみられながらも精神外科が、なぜ、大々的に行われたのか、その理由を説明してくれます。
当時、精神疾患医療の現状にアメリカを含め世界中の精神科医たちは困惑し、窮地から脱する手段を探していました。当時、まだ、クロルプロマジンなどの向精神薬や三環系抗うつ剤、リチウムといった躁病薬、ベンゾジアセピン系抗不安薬はありませんでした。とくに、精神科病床の大半を占拠していた統合失調症(精神分裂病)に対してはほとんどなすすべがありませんでした。疲弊している家族を救うためにとりあえず患者を病院に収容、しかし有効な手立てはほとんどなく、暴れ回る患者を縛り付け、拘束しているだけという病院も少なくありませんでした。精神療法(心理療法)や行動療法がいろいろ試されましたが、それによって社会復帰に至る例はあまりありませんでした。それを補うために、人為的にてんかん発作を起こさせる電気ショック療法、あるいは、インシュリンを注射して低血糖発作をおこさせるインシュリン・ショック療法などがやられていました。ショック療法で症状の急性悪化を一時的に抑え、症状が軽減している間に精神療法、行動療法などで社会との接点をなんとか作りだし、社会復帰につなげようようという試みです。しかし、こうしたショック療法は一時的には効いても、長期的にみて根治できる治療法ではありません。うまく退院につなげられる例は限られていました。そうした中、とくに、アメリカでは、州立病院などの公的病院が予算不足もあって悲惨な状況に追いやられていました。1964年のケネディー大統領による精神病・精神薄弱に関する大統領教書は精神病患者が「時代おくれの巨大で超満員の州立病院に、すし詰めの状態で閉じこめられ」「こういう事態は、今まで余りにも長い間、放置されてきた。それは、われわれ国民の良心の痛みであったが、また、口にするのも不愉快で……….しかもその解決はほとんど絶望的な問題であった」と非難していました(Special Message to the Congress on Mental Illness and Mental Retardation:野田正彰訳http://www.arsvi.com/d/m01h1963k.htm 2021年8月閲覧)。こうした中、精神外科が切り札として登場したのです。たしかに電気ショックなどで思うような効果が見られなかった患者にも劇的な行動の変化をもたらされることがあり、行動療法につなげることによって退院に至る例もありました。そうした期待の星に対し精神科医は多少の問題には目をつぶったのです。
しかし、3分の1の症例でてんかん発作を引き起こし、さまざまな副反応を起こす精神外科はさらなる技術の改変が求められました。そうした中で編み出されたのが、てんかん外科の深部電極設置においてタレラックたちが行ったように、頭を器具で固定し、計測と計算によって狙いを定めて脳の深部組織に針を差し入れ、通電によって脳組織を凝固させたり、薬品で破壊したりする方法です。定位脳手術といいます。正確にピンポイントで狙った組織を破壊するので副反応の頻度が減ることが期待されました。
そうした術式の改変と並行して、積み重ねられたデータを基に、対象疾患、対象症状、標的組織も狭められていきました。対象疾患としては統合失調症が何といっても多かったのですが、モニスが最初に気づいていたようにこの疾患への効果は思わしくないことが知られるようになりました。このため、不安神経症や重度うつ病へと対象疾患、対象症状が狭まっていきました。そして、標的組織も、大脳の深部に位置する内包前脚、基底核、帯状回、辺縁系に限定されるようになりました。
こうして手術件数は減っていきました。そして、向精神薬の登場によって精神外科の出番はほとんどなくなります。
1950年代半ば、抗ヒスタミン薬として開発されたフェノチアジン誘導体のクロルプロマジンが統合失調症(分裂病)の諸症状を緩和することが発見され、瞬く間に、全米だけでも200万人近くの精神病患者に投与されました。クロルプロマジンは神経を遮断して興奮状態を抑えるというのが売りで、実際、妄想が軽減し、おとなしくなって、退院、職場復帰が可能となった例もありました。ただ、クロルプロマジンのいかなる薬理作用によって「おとなしくなる」のかは分かっていませんでした。その後、クロルプロマジンはドーパミン受容体を抑制することが判明しましたが、しかし、それでは、ドーパミン受容体を抑制するとなぜ「おとなしくなる」のかとなると、これについても、いまだによく分かっていません。その意味では精神外科と同じです。また、気力低下、不随意運動をはじめとして少なからぬ副作用もみられます。しかし、「おとなしくなる」という作用を考えて目をつぶろうということになりました。これも、精神外科の場合と似ています。しかし、脳に侵襲を加える精神外科に比べ、薬を飲むだけの方が少なくとも手術と違って脳に非可逆的変化を起こしません(ただし、ずっと飲み続ければ、同じことですし、絶対に脳の器質性変化をもたらさないという保証も実はありませんが)。さらに、手術という侵襲的手技にともなう危険、煩雑さも薬の服用にはありません。このようにハードルが低いと感じられたためでしょう、薬物療法はしだいに手術件数の減った精神外科の穴を埋めていき、そのことが精神外科手術の施行数をさらに減らしました。加えて、抗うつ薬、ベンゾジアゼピン系抗神経症薬の登場が精神外科の出番をほとんどなくしました。
もちろん、そうした薬も万能ではありません。このため、薬によっても症状を抑えきれない症例に対して「最後の手段」としての精神外科は残りました。その点では、てんかん治療におけるてんかん外科の立場と似ています。しかし、精神外科はてんかん外科とは比べものにならない厳しい枠がはめられるようになります。厳密なガイドラインが設けられ、適応疾患、適応症状が限定され、実施病院もしくは施設の倫理委員会による審査による何重もの関門を経なければならないという要件が課せられるようになったのです。
そうなった背景には、1960年代から70年代にかけて湧き起こった精神外科への猛烈な批判がありました。精神外科は危険かつ有害で、人間性を否定するものであり、治療の名に値しないものだと糾弾されるようになったのです。こうして、精神外科には忌まわしいイメージがつきまとうようになります。
精神外科批判が巻き起こったこの時代には、上に述べたように精神外科手術はほとんど行われなくなっていました。なのに、なぜそんな時になってバッシングともいえる批判が湧き起こったのか、いまひとつよくわかりません。橳島は精神外科手術が粗暴患者や精神病質者、反社会的行動を起こす人間にまで適応が拡大され、乱用されるようになったことを要因の一つとして挙げています(橳島次郎(2012))。事実、刑務所の受刑者に精神外科手術が行なわれたり、精神病質の性犯罪者に退院の条件として精神外科手術が課せられたりしていることが明るみに出て、マスコミ、議会、市民運動家は精神外科に批判の集中砲火を浴びせました。これが精神外科への大きな逆風になったことはたしかでしょう。
しかし、この時代、一般の人々の間で精神外科のみならず、精神医学そのものに疑念が生じていたことも思い起こす必要があるかもしれません。
精神医学への疑念が芽生えた原因の一つは、イギリスのレイン、クーパーといった精神分析医たちが提唱した反精神医学でした。精神分裂病(統合失調症)は病気ではないという主張がなされたのです。家族や社会からはじき出された人間に精神分裂病というレッテルを貼って精神病院に押し込めているにすぎないというのです。「伝統的正統的主流的精神医学の狂気観に対する根本的な異議申し立て(笠原)」でした。その代表選手ともいえるレインは次のように主張しています。
「精神医学は、超越の側に、本当の人間的成長の側に立ちうる学問である。そして、精神科医の何人かはその側に立っている。しかし、精神医学はいとも簡単に洗脳の技術とも化しうる。つまり少しも傷害的でない拷問によって人間に適応的行動を引き起こさせる技術となり得る。拘束のための保護衣がもはや見られず、ドアに鍵がなく、ロボトミーという脳手術が大幅に捨てられた最高の場所では、それらがもっと微妙な型のロボトミーやトランキライザーによって置き換えられている。そしてそれが患者の「内側に」ベットラム(精神病院)の閂と錠前の下りた扉をおくのである」(レイン RD (1973) 笠原嘉監修、阪本健二、志貴春彦訳. 「ひき裂かれた自己」 ペリカン版への序)
反精神医学は、当初、奇異な目で見られ、反対意見も少なくなかったようです。しかし、やがてフランス、イタリア、アメリカに同感の輪が広がり、日本にも影響を及ぼしました。その後、反精神医学は下火になっていきましたが、1960年代には例のケネディー大統領教書の影響もあり、精神病院から大量に患者を「開放」する動きを後押ししました。この反精神医学の立場からいえば統合失調症(分裂病)は病気ではありませんから、精神手術は病気でも何でもない人間の脳にメスを入れているということになります。これでは、同意を得ていたとしても精神外科は人体実験、同意を得ていなければ治療の名に値しない傷害罪ということになります。
もうひとつ、精神疾患の診断基準が十分に定まっていなかったことも精神医学への疑念を深めました。臨床徴候、臨床検査、画像などの客観的所見に頼ることのできない精神疾患、精神症状の診断、治療の基盤は、ある意味、脆弱でした。1973年、アメリカの心理学者ローゼンハンはこの精神医学の欠陥を突く論文を発表、大論争を巻き起こしました(Rosenhan DL(1973) On being sane in insane places. Science)。精神病を騙って徴兵逃れを試みる人間に興味を抱き、その実態をじっくり検討していたローゼンハンは友人、知り合い7人に声をかけ、ある実験を試みました。ローゼンハンを含め精神疾患のない8人が嘘の幻聴を訴えてさまざまな精神病院を受診したのです。すると、7人が統合失調症、1人が躁鬱病と診断され、8人全員が7日から52日間(平均19日間)入院治療を受けることにまんまと成功します。全員、初診時以外は通常の振る舞いをしていたにもかかわらず、各病院の担当精神科医は誰もこの8人が正常な人間だと見抜くことができませんでした。初診時に下された診断も退院時まで変更されることがなかったのです。むしろ、病棟の患者たちのほうがこの偽患者たちの嘘を見破っていたようです。この「戦果」を報告した論文の冒頭でローゼンハンは「精神病院では狂った人間と狂っていない人間を区別することすらできない」と揶揄しました。当然、精神科医たちからのすさまじい反論が押し寄せました。しかし、ローゼンハンの戦況報告によって点火された精神疾患診断への疑惑は容易には払拭されませんでした。防戦に立たされたアメリカの精神科医は必死の思いで戦略を練り、その中から、1972年、実証的研究のための診断基準、Feighner基準を作成しました。さらに、Feighner基準を基に精神疾患のデータを積み重ねて検討したIowa 500 Studyが行われ、1974年にはコロンビア大学によって研究診断基準が作成されました。しかし、何といってもインパクトが大きかったのは1980年に策定、公表された精神疾患の診断・統計マニュアル(Diagnostic and Statistical Manual of Mental Disorders(DSM))第三版でしょう。元々DSMは統計をとるためにつくられたマニュアルでしたが、手順に従っていけば診断にたどり着けるようにみえるこの第三版は評判を呼んで、世界中に翻訳され、各国の医者がこれを座右において診断に参照するようになりました。おかげで、標準的で均一な診断方法が世界中に広まりました。この「機械的」診断方式には今でも批判がありますが、診断基準がある程度明確になったのはたしかです。少なくとも、診断のブレは減ったようです。しかし、第三版が出たのは1980年のことです。1960年代、診断があやふやだったことは精神医学、そして、ひいては精神外科への疑惑を招き寄せました。
「カッコーの巣の上で」
この精神医学への疑惑を如実にあらわす小説が1962年にアメリカで出版されます。27歳のケン・キージーが書いた「カッコーの巣の上で」です(ケン・キージー(1962) 岩本巌訳 「カッコーの巣の上で」 パンローリング株式会社)。刑務所の作業農場で喧嘩に巻き込まれ、裁判で精神錯乱と鑑定され精神病院に送り込まれた自由人マクマーフィを主人公とする小説です。精神病院の急性期病棟が舞台になっていますが、マクマーフィはともかくとして、語り部の混血インディアン、ブロムデンも含めてこの病棟の患者は精神病などには罹患していないかのように描かれています。「すべすべして、計算されたように作られている顔」の師長を先頭にたてた精神病院によって心の自由を奪われた人間として表現されているのです。「ひどいね、こりゃ、みっともない連中ばかりだね。だが、あんたらはみんな、おれには精神異常者にはみえないぜ」とマクマーフィは毒づきます。かれの言葉は反精神医学の概念を体現し、ローゼンハンが指摘した精神病院の実態を鋭く突いています。やがて、野生児マクマーフィの予測不能な言動に鼓舞された患者たちは心の自由を取り戻していきます。しかし、マクマーフィが可愛がっていたビリーを師長が精神的に追い詰めて自殺に追いやったことで、怒り狂ったマクマーフィは師長の首を締め上げます。職員に取り押さえられてマクマーフィは拘束され、慢性病棟に引き連れられていきます。そして、数週間後、ロボトミーを受けさせられ、廃人となって急性期病棟に戻ってきます。マクマーフィの手術の場面はでてきませんが、ブロムデンがロボトミーに関して次のように呟きます。
「患者が脳手術に連れて行かれる時、ひどく腹を立て、世界中を呪いながら病棟を出ていく。そして、二,三週間後に、(経眼窩式ロボトミー手術によって)ものすごい喧嘩をした時のような黒痣のついた目をして戻ってくると、こんどは、じつにおとなしい、行儀のよい人間になってしまっている。帽子を目深にかぶって、一つの幸福な単純な夢だけを見て、さまよい歩いている夢遊病者のような顔をその陰に隠しながら、1、2か月して、退院する場合だってある。これを成功例と病院では言うが….(術後の患者は病院の背後にいる何者かが)作りだしたロボットにすぎないといいたい(括弧内は引用者補注)」
当時の読者はこうした表現にさほど違和感を覚えなかったようです。小説はベストセラーになりました。1964年の時点で一般の人にとって精神病院と精神外科はこの程度のものという認識になっていたのかもしれません。
反権力闘争
この小説が発表された頃、アメリカには奇妙な風体の人間が徘徊するようになっていました。愛と平和(Love&Peace)を訴え、既存の道徳観や生活様式に反抗し、ジーンズや民族衣装風のラフな衣服を身にまとい、髪やひげを伸ばし放題にした若者たちです。マリファナを吸って精神を解放し、自然へ回帰するのだと広言するものもいました。大人たちの眉をひそめさせるこうした反抗的な若者はヒッピーと呼ばれました。かれらが反発したのは、とりあえずは、第2次世界大戦以前に生まれた父親世代の家父長的倫理観だったようです。戦後世代に属するケン・キージーもこのヒッピーに共感、そのパトロン的存在になっています。1960年代前半にカリフォルニアで結成された「メリー・プランクターズ(陽気な悪ガキども)」という集団の共同生活を支援、1965年には奇抜なサイケデリック模様が塗装されたバスにこの集団と乗り込んで、幻覚剤LSDによる精神の開放を訴え、ニューヨークに向かって大陸横断のツアーを試みました。
このヒッピースタイルはやがて世界中に拡散し、驚いたことに、専制主義的共産主義政権下にまで現れました。そして、当初は無目的にみえたヒッピーの反逆はやがて反権威、反体制、人権擁護を訴える運動へと溶け込んでいき、これも世界中に広がっていきます。1960年代から1970年代にかけてアメリカ大陸、ヨーロッパ大陸、そして、日本を含むアジアで、権威への嫌悪、反発を起爆剤とした過激な運動が世界同時多発的にみられるようになったのです。ヒッピー同様、第2次世界大戦後のベビーブーマーである若者たちが、既成の制度、政治指導者、政治組織の非合理、人権侵害に対し、デモや座り込みなどで抵抗の意思を示し、時として、道路封鎖、施設侵入、建物占拠、暴動といった過激な不法行為へと発展しました。舞台の中心は大学でした。1964年にアメリカのカリフォルニア州、バークレーで始まった大学紛争は1968年にもっとも盛り上がりをみせ、同年春にはアメリカで一月足らずの間に30校にものぼる大学でデモが行われ、その動きはハイスクールやジュニアハイスクールにまでひろがっていきました。
運動の矛先はなによりも人権抑圧でした。アメリカでは、黒人の人権擁護を求める公民権運動がその大きなきっかけになりました。運動の中心はガンジーの無抵抗主義を旗印に掲げるキング牧師でした。かれの抵抗運動を取り巻く世界には一定の型がみられました。キング牧師とその仲間が行動を起こすと、権力側が暴力をもって抑圧しました。これがマスコミの格好の餌食になりました。棍棒でなぐなられるキング牧師たちがテレビ画面に映し出され、続いて、人々の良心に訴えかけるキング牧師の見事な演説が流れ、反逆的な若者たちを中心に公民権運動支持の輪が広がりました。ガンジーが先導した運動同様、この劇場型人権擁護運動はアメリカのみならず世界中で注目され、その手法は世界中の反権力闘争の手本になりました。しかし、公民権運動はやがてキング牧師の手を離れて先鋭化し、各地で暴動をひきおこすようになります。これに対し、当局は装甲車まで使って鎮圧しようとしました。そして、1968年、キング牧師の暗殺によって運動は収拾のつかない混迷状態に突入します。
反権力闘争のもう一つの大きなスローガンは、反戦でした。衛星放送とビデオ録画を使ったTV放送を通じてベトナム戦争の実態が連日のように伝えられると、共産主義の脅威に対する戦いの勝利は近いという政府の宣伝にアメリカの若者は疑いの目をむけるようになっていきました。アメリカ兵の死者が一万を超え、徴兵でベトナムに送られる若者たちは、明日は我が身という切実な状態に追い込まれていました。戦争の停止を求めて無数の若者が大学やハイスクールで座り込みsit-inやデモを決行、はては、学校の建物を占拠することさえありました。しかし、明日は我が身ではないアメリカ以外の国でも戦争に反対する運動が湧き起こり、そうした国でも反戦といえば反ベトナム戦争でした。日本では「ベトナムに平和を!市民連合(ベ平連)」が結成され、「良心的脱走米兵」の逃走を支援しました。この良心的脱走米兵の逃亡先はカナダやスウェーデンでした。さらに、日本では、ベトナムに派遣される原子力空母エンタープライズの佐世保港入港を阻止しようと全学連が数千人規模のデモを繰り広げました。米帝反対(米国帝国主義反対)が合言葉になっていました。
この反権威闘争は恐るべき感染性を有していました。国を超えて容易に飛び火したのです。パリでバリケードが築かれ、若者たちが投石すると、すぐに、アメリカ、日本、ドイツ、イタリア、ポーランド、メキシコに同じ光景があらわれました。ある国、ある都市のある一つの動きがすぐに他の国、他の都市に燃え移っていきました。感染を媒介したのはマスコミ、とくにテレビでした。衛星放送で世界がつながり、はるか遠くの国で起きたことがその日のうちにビデオに撮りためた映像で映し出され、どの国にあっても、身近なことと感じられるようになりました。文明批評家マクルーハンが予言したグローバル・ビレッジ(地球村)が実現しつつありました。映像を通じ反権力主義運動の抵抗手段が模倣され、加速度的に「戦術」が強化されたのです。
この反体制闘争には奇妙な特徴があったと「1968年 世界が揺れた年」の著者マーク・カーランスキーは指摘しています。
「反体制運動は計画的なものでも組織化されたものでもなかった。抗議活動は緊急の話し合いで決められた。きわめて重要な決定もその場の思いつきで下されてしまうこともあった。活動家たちは反権力主義者だったので、かれらには指導者がおらず、いたとしても当人は指導者であることを否定した。イデオロギーは曖昧で、幅広く意見がまとまることもほとんどなかった(マーク・カーランスキー「1968年 世界が揺れた年」)。」
ヒッピー的特性が残存していたのです。指導グループが「昼飯のことでも意見が合わない」有様でした。世の中を混乱に陥れる激しいうねりを作りだしていたにもかかわらず、個々の運動の中心人物ははっきりしないことが多く、明確な指導原理がないこともめずらしくありませんでした。正義の唯一のあかしは権力を持っていないことでした。あるいは、権力を持とうとせず、かつ、純粋無垢であることでした。少なくともそのようにみえることが条件でした。運動が特定団体への利益誘導であってはならなかったのです。
こうした反権力闘争がすべてうまくいったわけではありません。たとえば、強権的で専制的な力が支配するメキシコやチェコでは抵抗運動がとてつもない武力によって完膚なきまでに蹴散らされました。しかし、吹き荒れた嵐の中、反対運動によってアメリカ軍はベトナムから引き上げざるをえなくなり、ベトナム戦争は北ベトナムの勝利という形で終結しました。また、黒人を含めたマイノリティーの平等を保障する法律も整備されました。このように、反体制運動が一定の成果を上げたところもあったのですが、嵐が過ぎ去るまで首をすくめ、腰をかがめてやり過ごし、しぶとく生き残った既成権力、既得権益集団も少なくありません。そうした中、うまく立ち回れず、逃げ場を失い、無残に引き倒されていったものもありました。その代表格が精神外科でした。医者が権威を振りかざして十分な根拠もないまま膨大な数の人間の脳を切り取ったという悪評が立ち、精神外科はこの反権威主義の嵐の中で格好の標的になりました。表舞台に引きずれ出され、過去の問題をほじくり返されると、逃げ場がありませんでした。手術件数も激減し、弁明する人間もほとんどないなくなっていた精神外科はサンドバックのように打ちのめされ、消えていきました。
似たようなことは、たとえば、優生学でも起きています。「デンマーク、スウェーデン、ノルウェイにおける優生学と福祉国家による不妊手術」の編著者ブロボーグは「1930年代にはまだ支配的だった家父長的倫理観が1960年代から1970年代にかけてひとりひとりの人権を重視する自由主義に道を譲り、新たな不妊法に改正され、全く異なることが行われるようになった」と書いています。知的障害者を大規模施設に押し込め断種を行うという北欧やアメリカの優生政策が戦後徐々に廃止され、知的障害者を施設から解放し、一般社会の中で当たり前(ノーマル)に生活できるようにするノーマリゼーション政策が正面に踊り出てきたのがこの頃です。「反権力主義の考えが優生学を完膚なきまでに打ち倒した」とブロボーグは記しています。イギリスで誕生し、北欧、米国、ドイツで優生政策を生み出すことになった優生学も、精神外科と同じように、当初は先進的な医者や科学者が先頭に立って推し進め、文化人やマスコミによって世界中でもて囃された学問でした。しかし、第二次世界大戦後、ナチスドイツの所業もあって勢いを失い、この反権力主義、人権主義の嵐の中で消えていきました。
1970年代半ば、反権力闘争の嵐が静まっていく中、小説「カッコーの巣の上で」が映画化されました。この映画は大ヒットとなり、米アカデミー賞の主演男優賞、主演女優賞、作品賞、監督賞、脚色賞の主要5部門を独占、今も、この時代を代表する名画とみなされています。映画は強制的にロボトミー手術を受けさせられたマクマーフィが腑抜け状態になって病棟に戻ってくる場面で終盤を迎えます。両こめかみにロボトミー手術のあとが残ったうつろな顔のマクマーフィを演じたジャック・ニコルソンの名演技はロボトミーの悪評を決定的なものにしました。この悪評に対し、ロボトミーを擁護し、反論する人間は、もう、一人も残っていませんでした
1977年、アメリカ議会は国立衛生研究所に精神外科問題の検討を指示しました。そして、生物医学研究と行動研究に対する人権擁護国民会議はボルチモアで会議を開催して報告書(ボルチモア報告)を作成、精神外科を引き続き制限するよう勧告しました。しかし、この頃には難治性精神疾患に脳切除術を行う施設はもうほとんどありませんでした。
こうした事態に至った原因の一つとして、精神外科の治療成績がきちんと検討できていなかったことが挙げられるでしょう。
前頭葉という多彩な機能の脳葉を切り刻むことによって一筋縄ではいかない複雑で多彩な効果と合併症がもたらされました。そのことが精神外科の評価を困難にしました。しかも、手術によって切断される標的神経結合は術式によって(ときには同一術式であっても)異なり、当然、その効果も合併症もバラバラで、簡単にはまとめきれませんでした。複雑怪奇な結果がもたらされました。もちろん、中には予後が良好な症例もあったことでしょう。そうでなければ、精神病院がいくらどうしようもない状況におかれていたとはいえ、アメリカだけでも一万人をこえる患者に精神外科手術が行われることはなかったはずです。しかし、深刻な合併症が少なからずあったこともたしかです。
さらに、結果を評価する際の価値判断の転換がありました。たとえば、前頭葉と皮質下組織の経路が切り離されて、感情と遂行能力が離断されると、たしかに、感情の激発による異常行動が抑制されたようです。それまで、わけもわからず、叫び、ものを壊し、人に殴りかかっていた人間がマクマーフィのように「おとなしく」なりました。そして、当初、これが掛け値なしのロボトミーの効果とみなされたようです。しかし、人間は感情に裏打ちされた価値判断で行動します。なのに、感情と行動をつなぐ糸が引きちぎられれば、行動の牽引力が失われます。無気力で空虚な生活が延々と続くことになります。外からみれば行動の改善とみえるものも、内面においては耐えがたい意欲の喪失かもしれません。
そのどちらに視点を合わせるかによって評価は逆転します。
大まかにいえば、精神外科手術は「外からみた患者の行動の変化」に目が向いていた1940年代、1950年代は「革新的な治療」ともて囃されたものの、1960年代以降、目線が患者さんの内面に転じると「極悪非道の仕業」と罵られるようになったようです。
こうして、モニスのノーベル賞はノーベル賞選考委員会が与えたもっとも恥ずべき賞と非難されるようになり、フリーマンはナチス医師団と並び20世紀のもっとも忌まわしい医者と指弾されるようになります。晩年フリーマンはロボトミーを行った症例一人一人をキャンピングカーで訪ね回ったり、患者宅に電話をかけたりして、術後経過を確認しています。しかし、名誉は回復しませんでした。
医学の歴史には、和田テストのように、勇気をもって大胆な一歩を踏み出し、医学に革新をもたらした輝かしい事例が沢山あります。モニスもまた大胆な一歩を踏み出した人物でした。しかし、彼の始めた精神外科は、そうした輝かしい事例に入れられてはいません。問題があまりに多すぎました。
しかし、精神外科をタブー視して単純に否定しさっていいものでもないでしょう。タブー視は思考停止につながります。議論が絶えた時点で、なんの教訓も得られなくなります。ところが、あれほどの数の症例に施行されたにもかかわらず、批判の嵐の中、精神手術はきちんとした最終評価がなされないまま、歴史の底に沈んでいきました。
「心は実験できるか」の著者、ローレン・スタイナーは20世紀になされた心理学や精神医学の試みを辛辣な言葉で記している人ですが、精神外科を扱ったチャプターでは、数十年にわたる重篤な不安神経症が定位手術で軽快した男性を感動的に描きだし、この「現代のロボトミー(精神外科)」を肯定的に評価しています。そして、精神外科の創始者モニスについて次のように評しています。
「モニスは人の命の領域に大股で歩み入り、手にすべきでないものに手を出した。それ故にかれは嫌われている。だが、それで有益なものを残した。彼の業績のすべてが有用である。精神外科の父であるモニスを嫌うことはできる。だが、そういうあなたの頭がさまざまな形でモニスに救われているということは十分にありうる(ローレン・スタイナー(2005) 岩坂彰訳 「心は実験できるか」)」
また、「精神を切る手術」の歴史的経緯を詳述した橳島もロボトミーを単純にタブー視する風潮に疑問を投げかけています。
「H・Mという稀有な例が示すのは、精神外科手術の思わぬ副産物のおかげで記憶と学習の神経学的基盤を解明する脳科学の一分野の今日がある、ということである。これは、H・Mの例ほど劇的ではっきりした形でなくとも、ロボトミーに始まる様々な精神外科の手術を受け、その結果が脳科学の知見に与えた、ほかの多くの人たちのケースでもいえることであろう。
そのすべてを、私たちは過去の悪行として糾弾し否定するだけでよいのだろうか。そうした犠牲の上に、今日の精神医学と脳科学の基礎が築かれている面があるということを、認めないでいいのだろうか。
昔の乱暴な精神外科にも役に立ったことがあったのだなどといいたいのではない。今の脳科学は過去の過ちの十字架を背負っているとあげつらいたいのでもない。脳と精神の臨床と科学研究の間には、倫理的にはっきり黒白がつけられない、断罪か賞賛かどちらかではすまない、複雑な歴史があるということである」(橳島次郎(2012)「精神を切る手術」岩波書店)
結局、精神外科は定位脳手術の手法を取り入れた形でわずかに生き残ることになりました。向精神薬でも症状が抑えられないきわめて限られた症例に、厳格な管理の下、今でもアメリカのいくつかの州では行われています。
ソ連と中国の精神外科
精神外科はソ連と中国でも行われましたが、この二つの共産主義国家では精神外科への対応が欧米の自由主義国家とは違った経過をたどることになりました。
ロシアでは革命前の1908年にすでにエストニア出身の脳神経外科医、ルセップが精神運動性興奮を抑えることを目指して前頭葉と頭頂葉の連合線維を裁ち切る手術が行っていました。しかし、本格的に精神外科が開始されたのは革命によってソ連となった後のことで、とくにアメリカのフリーマンの仕事が紹介された1940年代に入ってから手術数が増加しました。まずは前頭前野白質切截術が行われたようですが、その後、開頭下の白質離断術が考案されました。しかし、これは術後の頭蓋形成を要する時間のかかる術式だったため、その後、レニングラードの脳外科医、バプチンによって冠状縫合前で2cmの穿孔を開けてヘラで線維接合を切断する術式に変更されました。これによって、手術を受けた患者の半数が退院でき、このうち3分の2は仕事に復帰できたという報告がなされています。さらに、感情の激発を抑え、将来の不安を緩和するのでバプチンは癌の疼痛に対しても白質切断が有効かも知れないと考え、実際に試みました。
しかし、ソ連でも精神外科に対して推進派と反対派がいました。そうした中、1949年に精神外科を検討する全ソ連科学協会主催の全体会議が推進派、反対派両者の出席のもと開催されました。そして、前頭葉白質切断術は科学的見地からみて基本的に容認できるという最終結論が、一応、だされはしました。ただし、対象はインシュリン療法や電気ショック療法が無効で、将来にわたって症状の改善が見通せない統合失調症患者に限定すべき、という厳しいタガがはめられました。
翌年の1950年に開催された同会議でも同じように精神外科を容認する意見が多数を占めました。ただし、医学アカデミー協会精神医学部門の設立者で健康省大臣でもあった全体会議の議長ジリアノフスキーは元々精神外科に懐疑的だったようで「脳に瘢痕を残して器質病変をもたらし将来の治癒への道を閉ざすような前頭葉白質切断術ではなく、他の治療手段で分裂病(統合失調症)患者には対応可能だ」という意見を議事録に残すよう求めました。
そして、このあたりで純医学的な論争は終わりを告げます。
会議後、ソ連機関誌「プラウダ」に「似非科学的治療方法に対抗して」という精神科医と神経内科医の連名記事が掲載されます。
「ブルジョア医学の無能さを示す1例として現在アメリカ米国精神医学界で大流行の精神疾患「新治療法」が挙げられる。ロボトミーだ……パブロフの教えで身を固め、偉大なヒューマニスト精神の栄えある伝統のなかで育った我が国医師の間には当然ながらロボトミーなる治療が入り込む隙などない。にもかかわらず、大西洋をわたってきた似非科学の「成果」なるものを好むものがいる」
そして、矛先は指導的立場にある精神外科容認派精神科医と健康省に向かいます。
「かれらは今もこの似非科学の武器を捨てていない。この治療法は6年にわたって臨床の場で理論的正当性も臨床効果も十分に証明されないままに用いられてきている……健康省はなぜこれを許しているのか?」
「ブルジョア医学」「似非医学」という不思議な言葉が紛れ込んできています。医学以外の論理が顔をのぞかせはじめていたようです。モスクワ州立医学大学のリヒターマンは、その理由として、1950年にはすでに鉄のカーテンが降りており、東西冷戦によるソ連と西側諸国とのつばぜり合いが最高潮に達しようとしていたことを挙げています(Lichterman L et al. (2022) )。
精神外科を検討する2回目の全ソ連科学協会全体会議のあと、精神外科を検討する健康省主催の医学科学協議会が開催されました。その後、健康省大臣となる精神科医クラショフは会議で客観的な議論がなされるよう努めたようです。しかし、この会議は精神外科の可否を討論する場ではなくなっていました。政治裁判の場と化したのです。訴追者は精神外科反対派、そして、被告は擁護派でした。
反対派は精神外科が重篤な精神障害と退行をもたらし、とても治療などとは言えず、人工的に受動性をもたらす非人間的手法だと罪状を並べ立てました。
「白質切断によって患者は純粋有機体のごとき性質を帯びるようになり、精神的には自動機械になる。何日も働き続けることができ、疲れを訴えず、喜びも不快も示さない。白質切断者の観点からみた改善は「ロボット」を追い求めるアメリカ帝国主義の理想を体現したものだ……我々は健康人、病人いずれに対しても偉大なスターリン主義ケアを提供する素晴らしい機会が提供される時代に生きている。にもかかわらず、白質切断術提唱者は狭隘な局在論に縛り付けられている」
主犯格とされたのはソ連の精神医学を主導し精神疾患と神経病理に関する有名な著作のあるシュマリアンでした。かれは必死になって精神外科の弁護に努めました。精神外科が議論の余地のある治療法であることは十分承知している、しかし、他に治療法のない現状では使わざるを得ない治療法なのだ、と。しかし、はじめから判決が出ているような裁判では所詮は無駄なあがきでした。
追い詰められて、ついには、共産党イデオロギー(スターリニズム)の用語で弁護せざるを得なくなります。
「物事を一般的な政治に即して言及するのは避けたいが、同志スターリンの言説に従えば、我々は何が上部構造であり何が下部構造であるか認識している(下部構造は人間の日々の生産活動、経済活動などの物質的活動、上部構造はそれらに支えられたイデオロギー、宗教などの精神活動(筆者注))。そして、白質切断術、あるいは、患者の治療をめぐる問題は上部構造の問題ではない。このことから何がしかのイデオロギー上の結論を引き出すことができる。白質切断術は上部構造にかかわる問題ではないのだ(イデオロギーの入り込む余地などない、ということでしょう(筆者注))。
「分裂病は封建主義下にもみられたし、資本主義の下にも存在していた。そして、誠に残念ながら、我々は多くの疾病、とりわけ、分裂病を克服できないままに共産主義社会へと突入した、だから……」
「粗雑な機械論だ!」というヤジが発言を遮りました。
結局、この会議を統括していた共産党委員会は精神神経疾患への前頭前野白質切裁術はパブロフ生理学の教えに反するものであり、自制すべきであるとの決定を下します。そして、9日後、健康省は精神外科に対して「自制」という語彙を「禁止」に書き換えた文書を発布しました。
精神外科を禁ずる決定が下された後、スターリン支配下のソ連としては比較的「穏便」な処断が下されます。多くの精神科医が病院から追放されました。そして、その大半がユダヤ人でした。1940年代後半、ユダヤ人嫌いのスターリンに倣ってソ連高官たちの間でも反ユダヤ主義感情が高まっていて、これも精神外科論争が政治化した背景の一つだったようです。英国や米国の諜報機関の指令によってソ連高官に誤った治療を行ったとしてユダヤ人医師たちが投獄されたことさえありました(スターリンの死後、釈放)。投獄されないまでも、ソ連では脳神経外科医は精神外科と、それに類する外科処置を禁圧され、30年にわたってほとんど行うことができなくなりました。てんかん外科、疼痛軽減外科もその中に含まれていました。
精神外科が息を吹き返すのはソ連崩壊後のことです。ただし、白質切断術ではなく、アメリカでも行われていた定位脳手術による精神疾患の治療です。ソ連崩壊によるイデオロギー束縛からの解放がそれを後押ししたのでしょうが、それ以上に、MRIなどの画像診断技術、コンピューター技術の発展によって精神外科の医学的正当性が徐々に高まってきていたのが大きかったのでしょう。
| 付記) 前に申しましたように、ソ連における精神外科に対する反発が強かった理由として、リヒターマンは東西冷戦によって、フリーマンが主導していた米国におけるロボトミー隆盛に対する反発がソ連側にあった可能性を指摘しています。 しかし、それだけだったのでしょうか。 ご存じのように、ソ連では1930年代にスターリンによる大粛正が行われ、反革命の名の下、最低でも70万人近くが処刑され、60万人強の人間が強制収容所に送られています。反革命行動への政治的弾圧ということになっていますが、実際には絶対的権力を握ったスターリンの猜疑心がもたらした反対勢力(だとスターリンがみなした人間たち)の根絶だったともいわれています。粛清されたのは幹部政治家だけではありません。一般党員に加え庶民も粛清の標的になりました。スターリンは躊躇せず暴力に訴え、見せしめ裁判を行って人々を恐怖に陥れました。その際手足となって働いたのが秘密警察で、友人間、家族間の密告も奨励、人間関係をずたずたに切り裂きました。 さらに、スターリンはソ連の工業化を進めるにあたって、その資金と労働力獲得のために農業の集団化を強引におし進めました。そして、農業集団化に反旗を翻した農民を反革命の富農(クラーク)とみなして弾圧、処刑しました。さらに、飢饉になっても食物の強制徴発をやめず、このため、反発の強かったウクライナを中心に大量の餓死者がでることになりました。こうして、スターリンは自国民を1千万人以上死に追いやったと推定されています。 大粛清以降、反革命の名の下、ソ連のあらゆる分野で政治的粛清がなされるようになります。 科学も例外ではありませんでした。 医学生物学分野ではルイセンコという農学者が「科学者のスターリン」として粛清劇の主役を演じました。 ルイセンコはウクライナの小作農家の出身で、キエフ園芸専門学校を卒業後、育種試験場、選択遺伝研究所で植物の発生に関する研究に従事しました。その研究の成果のひとつが春化技術です。秋にまくべき小麦の種を高湿度、低温環境下に置いて春にまくと作物収量を増やすことができるというものです。収穫量の増大はたいしてなかったようですが、集団農場化と富農の粛正による食物収穫量激減に悩まされていたスターリンの目には魅力的に映ったようです。スターリンに支持され、ルイセンコは共産党幹部となりソ連における農業と生物学の支配者に昇りつめます。 それとともにルイセンコの暴走が始まります。「春化」によって種は新たな性質を得たと考え、交配と接ぎ木の効果も勘案して、ルイセンコは外部環境によって獲得された「春化」の形質は遺伝すると何の検証もなく主張するようになります。獲得形質が遺伝するというこのルイセンコの遺伝理論は、エンドウ豆の交配実験によってメンデルが発見し、ショウジョウバエでモーガンが確証した遺伝子説を否定するものでした。当時のソ連でも、名だたる生物学者たちは皆このメンデル・モーガン遺伝学を当然のことと考えていましたから、ルイセンコを嘲笑いました。しかし、この正統派遺伝学者たちはスターリンの集団農業化政策においてなんの「能力」も発揮していないと批判に晒されていました。「この国では、これまでのメンデル-モルガン式の遺伝学では、農業を指導することができないとされたことが、そもそもの問題の始まり(徳田御稔「二つの遺伝学」)」だったのです。このことに激怒したスターリンを後ろ盾にしたルイセンコは自分を卑下した生物学者たちを「人間嫌いのハエ愛好家」と罵り、メンデル・モーガン遺伝学は生命を遺伝子のみに還元して説明するだけの機械論だと切って捨てました。植物の遺伝的性質は生殖細胞全体が担っており、特定の微粒子(遺伝子)になど依存していないというのです。そして、集団農業を生き返らせたルイセンコ理論を否定する生物学者はマルクス主義に反対する連中だとスターリンの前で告発しました。ルイセンコは哲学者のミーチンらによって「歴史的過程において、積極的に食物と環境との間に割り込んで、意識的に環境を一定の方向に変えることを工夫し、植物体の進化の方向を変えさせ、その方向を人間に有利であるようにした・・・・・・ダーウィンの主張をさらに発展させ、生物学の中で唯物弁証法の方法を展開させた」と絶賛されました。メンデル・モーガン遺伝学を敵視するルイセンコとその信奉者の推し進める政策はルイセンコ主義と呼ばれるようになり、集団農業の惨状をルイセンコが緩和してくれることに期待をかけたソビエト当局によって強力に推し進められます。ルイセンコ主義によって遺伝学者を中心に多くの生物学者が投獄され、時として、処刑されました。そして、多大な業績をあげていたソ連の生物学は壊滅状態に追いやられます。 ルイセンコは穀物の低温処理に加え、樹木の塊状植え付け、独自の混合肥料など収穫量増大のためのさまざまな「改善策」を政府に提言、政府の御用新聞に農業界の救世主ともち上げられました。そして、そうした「処方箋」は有効性が検証されないままに強行施行されました。ルイセンコ主義の下、うまくいかなければ、悪いのは反マルクス主義担当者であって、「処方箋」ではないとされました。こうして、反対派を政治的に封じ込めて独善的になったルイセンコが提唱した農法は多大な被害を及ぼすことになります。 「収容所列島」の中で反体制派作家のソルジェニーツィンは農業技術者たちがルイセンコの命じるままに雪の上に麻の種子を撒いたところ、種子がすべて腐ってしまったとルポタージュしています。「種子は水分を吸収してふくれ、カビが生えだし、すべて駄目になってしまった。広い耕地が一年間空地のままに置かれた。ルイセンコは、雪が富農だといって非難することも、自分が馬鹿だともいうわけにはいかなかった。彼は、農業技師たちが富農で、彼の技術を歪曲したと非難した。こうして農業技師たちはシベリア行きとなった」。 ルイセンコ理論は共産圏の東欧、中国、北朝鮮などの共産国に受け入れられます。中国で大躍進時代に大量の餓死者が出たのはルイセンコの「処方箋」を取り入れた理屈に合わない農業政策が強行され、大凶作を招いたことが一因だともいわれています。 ルイセンコ理論は日本にも影響を及ぼしました。 発生学の大家、岡田節人は1949-50年ごろの日本について「大学でも、遺伝学から植物生理学まで、ルイセンコ派の教官が数多くはないにしろ存在していて、彼らはいわゆる若者たちにもてていた。」(ルイセンコの時代があった – 生物学のイデオロギーの時代にhttps://brh.co.jp/s_library/interview/30/)と京都大学大学院時代を振り返っています。しかし、やがて、「あれほどルイセンコ、ルイセンコと言っていた人たちも、間違っていたと明言もせず、いつの間にかゾローッと新しい生物学のほうへ変わっていった」。「世の中とはそんなものかもしれない」そうです。それでも「60年代に至っても、生きものの見方としては唯物弁証法にのっとったルイセンコ風の考えが正しいと書いていた物理学者が少しはいた」ようでルイセンコ主義の人気は根強いものがあったようです。事実、日本におけるルイセンコ論争を詳述した中村によると「ルィセンコ学説は、唯物弁証法の立場から正統的な生物学に向けられた”方法論的批判”として、戦後の進歩的生物学者の間に足場を固めて」いたようです。今となっては実感が伴いませんが、1950年代の日本の知識人を蔽っていた共産主義への憧憬がその底流にはあったのかもしれません。 ルイセンコが1950年のソ連における精神外科論争にどの程度かかわっていたのかはわかりません。しかし、ソ連における精神外科の運命はルイセンコ主義が引き起こした粛清パターンを彷彿とさせます。 |
中国でも精神外科は1940年台から行われていました。上海精神病院は90例のロボトミーを施行しています。ところが、ソ連で精神外科が禁じられたことを承けて中国人民共和国でも「イデオロギー上の理由」からロボトミーを禁じられます。まだ、中ソ論争が始まる前のことです。しかし、1970年初頭のニクソン訪中の影響もあったのでしょうか、1975年に中国でも難治性精神分裂病と衝動的行動に対して定位脳手術が行われ始めます。この時は、帯状回、扁桃核、尾状核を狙った手術でしたが、相変わらず分裂病を主な対象としていたこともあって、あまり効果がみられず、合併症も少なくなかったので1980年台に入ると一旦行われなくなります。しかし、21世紀に入ってCT/MRI画像を指標としたより精密な定位脳手術法が西欧諸国から導入され、対象も難治うつ病、強迫神経症、難治性疼痛などに変更されて、再び、精神外科が復活しました。
日本の精神外科
しかし、今に至るまで精神外科がまったく禁忌となってしまった国があります。
日本です。
日本における精神外科の始まりは外科医、永田瑞穂による1938年の前頭葉切除術施行とされています。しかし、盛んに行われるようになったのは戦後のことで、推進役となったのは精神科医でした。中でも東京都立松沢病院の精神科医、廣瀬貞雄は軍医時代の手術経験も生かして多数例のロボトミーを行い、日本のロボトミストと呼ばれました。1949年末の時点で精神外科は日本全国の28病院で2000例に施行されていましたが、そのうち230例が廣瀬によるものでした。廣瀬はその後、スコヴィルのアンダーカッティングを改良した術式を採用、日本医科大学精神科教授に転任した後も執刀を続け、総計523件の精神外科手術を行っています。
しかし、欧米同様、日本における精神外科手術件数もクロルプロマジンの発売を機に1950年後半から急激に減少、1960年代に入るとほとんど行われなくなりました。わずかに、定位脳手術が脳神経外科医の手で行われるだけになりました。
ところが、1971年3月、(東大)(東大)精神医学教室の臺弘教授が日本精神神経学会において、突然、ロボトミーに関して告発されました。1950年、松沢病院勤務時代に臺が精神神経誌に発表した「分裂病者脳組織の含水炭素代謝の研究」がロボトミー手術の患者の脳組織を不当に採取して行われたものであり、人権を損なう人体実験だったというのです。告発したのは同じ東京大学精神医学教室の石川清講師でした。
これは、奇妙な、唐突な告発でした。告発の対象となったのは20年以上も前のことですし、告発の対象は学会誌に掲載されたことのある、ある意味では学会公認の研究です。その研究の基になったのは例の廣瀬が行ったロボトミー手術に伴って採取された脳組織でした。これを使って臺が生化学的検討を行い、統合失調症の病因究明につなげようとする研究を行ったのです。なぜそれが、20年後に突然、学会の場で告発の対象となったのか、今ひとつわかりません。実際、日本精神神経学会はこの告発をうけて検討委員会を設置しましたが、すぐには結論を出すことができませんでした。しかし、2年後、日本精神神経学会総会において、「臺実験」は容認できず、患者の人権の軽視を学会として反省するとの見解が決議されます。そして、翌年の総会では精神外科を批判するシンポジウムが開催され、さらにその翌年の総会では、精神外科を否決する決議が採択されました。否決された精神外科には当時主流となっていた定位脳手術も含まれていました。こうして、精神外科は日本では一切行われなくなります。
「白い巨塔」と精神医療への疑惑の目
精神外科全否定の発端となった臺教授に対する唐突な告発を理解するには、当時の日本の医療状況、とりわけ精神医療の状況、そして、それを見つめる世間の目を知っておく必要があるかもしれません。
1965年、サンデー毎日に連載され評判を呼んでいた山崎豊子の小説「白い巨塔」が出版されました。野心家の外科学講座助教授、財前五郎を主人公として、大学病院を舞台に、医学界の権威主義的で封建的な世界を描いた物語です。「白い巨塔」はベストセラーになって、ラジオドラマ、映画、テレビドラマにもなりました。とくに、教授を頂点とする医局講座制と教授選にまつわる権力闘争、そして、その狭間で犠牲となる患者の悲話は旧態依然たる医学界の醜悪な側面をさらけ出したものとみなされ、折から、1960年代に日本にも吹き荒れ始めていた反権力闘争の批判の標的になりました。
一方で、精神病院も問題を抱えていました。前に述べたように、アメリカでは州立精神病院が大きな問題になりましたが、日本で問題となったのは私立精神病院でした。
太平洋戦争終結前後、日本の精神病院は危機的状態に追い込まれます。栄養失調で入院患者がバタバタと死んでいったのです。たとえば、1日平均在院患者数620人の都立松沢病院では昭和20年1年に480人が栄養失調で死亡、入院患者が半減しています。公定の配給量では命をつなぐことができず、かといって、闇の食料は入院患者の口までなかなか届きませんでした。この惨状のさなか、精神病院の数が激減しました。これに対し、政府は精神病院を粗製濫造することで現状を糊塗しようとしました。とにかく病床数が増えればいいというので、精神病院の設立者も管理者も精神医療の専門家でなくてもいいことになりました。しかも、格安の金利で建設資金が貸し出されました。このため、「精神病院は儲かる」という噂が広がって「精神病院ブーム」となり、精神病院設立者としてパチンコや果樹園の経営者までが名乗りを上げるようになります。院長が精神科以外の医者ということもめずらしくありませんでした。こうして、精神病院の数はうなぎのぼりで増えましたが、85%は私立病院で、一部の病院では医者も含めた職員のモラルの低下が著しく、患者は悲惨な状況におかれました。これに危機感を覚えた日本精神神経学会は1970年に私立精神病院の一部に対して警告的声明を発しています。一方、それに呼応するかのようマスコミによる精神病院暗部の暴露が相次ぎ、精神病院の評判を地の底に落とします。
中でも衝撃的だったのが1970年に朝日新聞に連載された「ルポ・精神病棟」でした。アルコール中毒者を装って大熊一夫記者が都内のとある私立精神病院に入院、その悲惨な入院生活の見聞をもとに精神病院の悪辣非道を告発したのです。日本酒4合瓶一本に加えウイスキーをあおって何とか酔いどれ風をよそおい、妻と同僚に付き添われて大熊記者は精神病院を受診しました。零細印刷屋の長男、酔うと人に絡み、妻をなぐり、仕事をせず、幻聴めいたものもあるという触れ込みが効いたのでしょう、診察した院長は大熊記者の目をのぞき込んで「ホー、こりゃ飲んでる。入院だ、入院だ」と宣言、一分足らずの診察でまんまと大熊記者は入院ということになります。ローゼンハンの日本版です。最初に入れられたのは錠のかかる鉄扉で閉ざされた保護室という名の独房でした。床に穴が開けられただけの水洗便所は水を流すと床にしぶきが飛び出てきました。割れた窓のガラスからは冷気が吹き込み、寒さに震えてもぐりこんだ毛布は水洗便所と同じような耐えがたい臭いを発しました。このまま精神病院に閉じ込められるのではないかという不安に駆られ、大熊記者は壁に書かれた「自由、自由、神さまお許し下さい」という落書きの言葉をそのまま叫びたくなる衝動に駆られます。
病院の玄関や家族用応接室のシックな装いとは真逆の世界でした。
食事は冷え冷えとした麦飯と味噌汁にわずかなおかずがデコボコのアルマイト食器で提供されました。食器はべとべとに濡れていて、とても洗剤で洗ったようにはみえず、割り箸も水でふやけていました。風呂場の浴槽のタイルや桶には垢がこびりついていて、湯を入れると一斉に浮き上がってきました。浴場で、認知症の老人たちの身体を洗うのは若い患者たちの仕事でした。この老人たちは「不潔部屋」と書かれた木の札が入り口にかかっている8畳間に6人が押し込められ、生きる屍のように終日仰向けのまま天井を見つめていました。医者の回診もいい加減で、大熊記者に対するアルコール中毒についてのカウンセリングは一切なし、理由の説明もなく、あと数か月の入院を要すると大熊記者に向かって宣言。この調子で、精神科病棟の生活環境の劣悪さと医療のいい加減さ、犯罪的病院運営が延々と綴られていきます。
精神科医の斎藤茂太はこのルポについて「一般の人々に正しい知識を与え、正しい判断ができるようにリードするマスコミの責任はいくら大きいと言っても大きすぎることはない。しかし、その「書きぶり」についてはどうもセンチメンタリズムとセンセーショナリズムがいささか過剰ではあるまいか」と苦言を呈しています。そして「問題点をわれわれの眼前にさらけ出してくれたことはわれわれも認めるのにやぶさかではない。ただはなはだ残念なことは、そういういわゆる『問題点』がどうして形成されたかをもう少し深く突っ込んで欲しかった」と付言しています。たしかに、大量の読者をもつ新聞の記事にしては、大熊記者の視野は限られ、精神病院にもぐり込んだ人間が目撃したものと、そこからの反射的感想を赤裸々に並べ立てているだけの印象があります。医療側の視点も含めて複眼的に考察し、問題点を掘り下げようとする気配が不思議なほどみられません。「監禁」「檻」「搾取」「鎖」などという刺激的な言葉が連ねられる一方で、こうしたことが起こってしまった歴史的いきさつについてのバランスのとれた解説があまりなされていません。読んでいると、まるで、自由人マクマーフィに大熊記者がなり変わったようにみえます。小説ならそれでもいいでしょうが、ルポとはいえ、新聞記事としてはやはり疑問が残ります。しかし、その単純化されたマクマーフィ的視点が読者の正義感をあおったのでしょう、ルポは大変な評判を呼びました。これを見て、他の新聞、週刊誌も追随、似たような精神病院暴露記事が相次ぎました。
| メモ6 「ルポ・精神病棟」が連載されたのは私が高校2年生の時で、ほとんど新聞を読むこともなかったのにこの連載だけは毎回欠かさず読んで、大熊記者に喝さいの声をあげていました。その後、名古屋にある大学の医学部に入学しましたが、入学式後、学生自治会が新入生オリエンテーションの一つとして上映したのが 田宮二郎が財前五郎を演じた映画「白い巨塔」でした。名古屋で開催された精神医学会で臺教授が糾弾された直後ということもあったのでしょう、キャンパス内には「台ノロボトミー人体実験反対!」の立て看板が並んでいました。台という名前を聞くと忌まわしいイメージを思い浮かべる同年代の医者が今も周りには少なくありません。 |
こうした悪評の中、医者をはじめ精神医療にたずさわる人々は危機感を強め、改革への模索を始めました。しかし、それをどのように解決するかにかんして意見が割れ、そのことが、最終的に、日本における精神外科タブー化にもつながることになります。
前にも述べましたように、1970年前後は、日本も反権力闘争の熱気に包まれていました。1968年の日米安全保障条約改正を阻止すべく、全国学生連合会(全学連)が社会党や共産党などと連携して活動を強め、騒然とする中、1960年代後半には、各地の大学で授業料の値上げなどをきっかけとして大学の運営や教育のあり方をめぐり、大学当局と学生が対立、いたるところで紛争に発展していました。学生運動の中心は、当初、共産党と連帯し、平和革命路線の堅持を表明していた日本民主青年同盟(民青)でしたが、穏健路線に飽き足らず「世界急進同時革命・武力革命」を叫ぶ中核派、社学同、社青同解放派などの新左翼と呼ばれた三派系全学連が登場、民青と対立するようになります。さらに、この新左翼系三派学生の集団にどの組織にも属さない(ノンセクト)学生が加わり、全学共闘会議(全共闘)なる集団が東大と日本大学(日大)に結成されます。要求を実現するために武力を厭わない武闘派集団で、バリケード封鎖や建物占拠を主導して名をあげました。しかし、全共闘は今ひとつよくわからない集団でした。学生と大学当局の争いが激しくなっていく中で何ということもなしに発生してきた学部を超えた全学的な組織で、各学部,学科,大学院,研究所などの代表からなる代表者会議がその中心をなしていました。特定の党派の支配を拒否し、そのため、いかなる党派にも属していない人間でも参加可能でした。「自分たちの要求を実現するための闘う組織」という以外、何の理念もなく、出入りは自由、闘争心に燃え、みずから全共闘のメンバーと名乗れば,だれでも全共闘になることができました。反権力闘争集団として集団の中にはっきりしたヒエラルキー(階層)はなく、自由参加の討議で闘争方針が決定されたので、主導者さえ曖昧でした。カーランスキーが指摘した60年代から70年代の反権力闘争集団の「計画的なものでも組織化されたものでもない、指導者がおらず、いたとしても当人は指導者であることを否定する、イデオロギーが曖昧で、幅広く意見がまとまることもほとんどなかった」という特徴を兼ね備えていた集団だったわけです。その後、全共闘は全国各地に広がっていき、大学当局と対立するのみならず、他の学生とも武力闘争を繰り返すようになります。
そうした中、東大ではインターン制度が紛争の発火点になりました。当時、医学生は卒業しても医師の資格をすぐに得ることができず、卒業後の1年間、無給でどこかの病院で研修し、それで、ようやく医師国家試験の受験資格が与えられていました。これをインターン制度といいます。第2次世界大戦中の医学教育レベルの低下を補填するために1946年8月「国民医療法施行令」改正によって創設された制度で、当初は先輩医師が懇切丁寧に臨床技術を伝える努力をしていたので、それなりに意味のあった制度だったようです。しかし、戦争の混乱がおさまって医学教育制度がそれなりに整ってくると、インターン制度は医学部卒業生にとって耐えがたいものになりました。医師の免許証もない状態で診療しなくてはならず、しかも、無給です。危険と隣り合わせの徒弟制度でした。これでは奴隷制度だ、と学生や研修医の怒り怒りの声が上がり、この制度を変更させるために、全国の研修医の間で医師国家試験ボイコットの動きがでてきました。そうした中、東京大学では、毎年一月になると医学生がストを繰り返し、1968年1月には無期限ストに入りました。
この混乱の最中、東京大学精神科教授、臺弘はインターン制度を検討する東京大学医学部「インタ−ン委員会」の委員に指名されます。インターン制度が憎悪の対象となっている中で、体制側教授委員は医学生、研修医の攻撃の標的で、火中の栗を拾うような役職でした。しかし、臺教授は「インターン制度は、有給、有資格の研修に切り替えるべきで、それができないなら廃止するしかない」と考えていました。これは学生の思いに沿うものでした。ところが、学生側が卒業後の臨床研修を東京大学病院の中で行うことを確約しろと要求すると(大学病院だけで卒業生全員をローテート研修をさせらるとは指導医の数からいっても保障できず、その一方で、人員設備の揃った大学以外の病院での研修も十分意味のあるものだという考えからでしょう)「君たちは依頼心が強すぎるよ、人生に保障などあるものか」言い放ってしまいます。学生には体制側教授による脅迫に聞こえたのでしょう、「学生たちはわっと怒って」臺教授に食ってかかったそうです。
1968年2月には東大病院院長と学生がもみ合いになったこともありました。この時、学生たちを制止しようとした病院医局長が学生に暴力をふるったと責められ、研修医、研究生、学生たちによって教授室に一晩監禁され、つるし上げられる事件が起きました。この監禁事件を起こした人間の中に精神科の医局員が交じっていました。臺教授が本人に問い詰めたところ、お調子者のこの医局員は関わっていたことを喜んで認め、医局長が座っていた椅子を医局長もろとも持ち上げて「ゴトンと落とす」まねまでして、うれしそうにこの監禁事件を解説したそうです。教授としては放置できず、この医局員を辞めさせることにしました。しかし、これによって臺教授は医局員の反発を喰うことになります。結局この事件で医学部長は事件に関わった研修医4人、研究生1人、学生12人の退学(4人)を含む処分を発表しました。この処分が東大紛争を収拾がつかないものにします。学生たちは事情聴取もせずに写真だけで当事者を同定したことに反発、とくに、現場にいなかったはずの学生まで処分されたことを問題視し、同年6月、全共闘の学生が中心となって医学部図書館、安田講堂に突入、占拠しました。臺教授はこの処分の白紙撤回を主張して学部長と対決したぐらいでしたが、問題の医局員の処分を医局内で発言していますから、どうやら、この処分決定にも関わった体制側反動教授とみられてしまったようです。
安田講堂占拠は機動隊の導入によって一旦は収束しましたが、機動隊導入は大学自治の侵害であり、学問の自由を危地におとしめるものだという批判が起こり、紛争は東大全体に広がります。こうして、7月に過激派学生が再び安田講堂を占拠しました。解決が見いだせないまま時間がすぎていく中、民青、全共闘、一般学生が対立、内ゲバによる流血事件も起こるようになりました(「ゲバ」とはドイツ語のゲバルトgewalt(暴力)の略で、当時の過激派学生の暴力行為に関連してよく使われた言葉です。たとえば、学生が攻撃に使う角材などの棒をゲバ棒、防御用にかぶるヘルメットをゲバヘルと呼んでいて、内ゲバとはゲバ棒などを用いた学生活動家間の武力衝突のことです)。この混乱した事態を収拾できずに東大教授たちは管理能力のなさをさらけだして世間の批判を浴びました。そして、同年11月、東大総長以下の幹部が退陣します。
この紛争の混乱の最中、臺教授を医局講座制の独裁者と見做して糾弾する集団が東京大学精神科の中に生まれます。全共闘系精神科医の集団、東大精神神経科医師連合(精医連)です。「旧来の権力密着的な医局・講座体制への決別を宣言する自立的医師運動集団(森山公夫(1975年))」を自称しました。委員長は臺教授を日本精神神経学会に「ロボトミー実験」で告発した石川清講師です。
精神科でそうした動きがある中、総長、医学部長、院長ら当局者幹部の辞任をうけ、法学部の加藤総長代行以下、各学部の新たな代表者が選出され、最高議決機関に出席するようになります。この時、医学部は医学部長、東大病院長、評議員が各一名代表者として出席することになりましたが、大学紛争の発端を作って辞任した医学部長に代わって新たに医学部長に選出された白木博治は本人の了解もとらずに臺教授を病院長に指名します。当局側の幹部となるわけで、安田講堂を占拠している活動家たちの批判の矛先になるのは目に見えていました。このため精神科教室員は全員、臺教授の院長就任に反対します。友人も心配して、病気ということにして臺を適当な病院に入院させようとしました。しかし、白木医学部長に説得されて臺教授は院長就任を承諾してしまいます。案の定、精医連は臺教授の院長就任を「東大闘争鎮圧に奔走する東大医学部の収拾工作」の先頭に立つものだと猛反発、「医局解散」決議を強行し、臺の不信任を可決しました。しかし、精医連が心配していたとおり、その後、安田講堂占拠は新執行部の要請による機動隊導入によって翌年1月に排除され、東大紛争は、その後、終息に向かいます。これを見届けて臺も院長を辞任します。しかし、院長時代、民青寄りの病院看護婦労組の相談に親身に乗ったこともあって、民青と対立していた全共闘系精医連の恨みをさらにかう事になります。
このように、騒然とした東大紛争の渦中にあって、臺教授は権力を振りかざす「反動的」教授の役割を演じていました。しかし、臺教授自身は自分ほど権力に似つかわしくない人間はいないと自認していました。というのも、若い頃から反権力闘争にかかわってきたオールドマルキストだったからです。思春期、青年期に「赤い(19)30年代」を過ごした臺はエンゲルスの「空想より科学」やブハーリンの「史的唯物論」を愛読し、高校生の時には左翼運動に関与した嫌疑で逮捕され、10日間留置されています。そして、その後も年に1度は憲兵隊分署に呼び出されて尋問されました。尋問の度に「我が国で一番えらい方はどなたか」と聞かれ、これに直立不動の姿勢で「天皇陛下であります!」と答えねばならず、この屈辱的体験が尾を引いて、晩年に至るまで臺は天皇制に反感をもっていました。東京大学医学部を卒業後、精神科医になったころには日中戦争が始まっていましたが、その当時、友人の家でたまたま遭遇したプロレタリア作家宮本百合子に「あなたがた、戦争が始まったらどうするのよ」「隠れなさいよ、あと十年たったらきっと天皇制はつぶれるわ」と詰め寄られています。しかし、「隠れる」ことができるはずもなく、結婚後1年にして招集され、独立自動車大隊の軍医としてベトナム、カンボジア、タイ、マレーシアを転戦します。そして、最後に送り込まれたパラオで生死の境をさまよい、九死に一生を得て帰国します。帰国後、東大精神科の付属病院ともみられていた都立松沢病院に勤務しますが、労働組合活動に熱中、病院の労働組合委員長まで努めています。一方、精神病患者の人権擁護にも熱心に取り組み、自分の担当病棟を地域社会に解放するさまざまな試みを看護師、作業療法士とともにしています。自分を権力に似つかわしくないと思っていたのも無理はありません。
しかし、一方で、臺は精神病を生物学的に検証しようとして松沢病院の生化学研究室で統合失調症(分裂病)の生化学的手法による病態解明にいそしみ、この時の研究の一つが、問題となった、ロボトミーで廣瀬が採取した脳組織の生化学的検討でした。この研究によって臺は覚醒剤慢性中毒患者と統合失調症患者の糖代謝に類似性があるのに気づき、その後、覚醒剤中毒の動物実験を通して統合失調症の病態を研究仲間と検討、医学賞を受賞しています。
臺は理学系頭脳の人だったようで、精神科を選んだのに、精神医学の柱の一つである精神病理や精神分析などにはほとんど興味がなかったようです。精神病理学の名著といわれるヤスパースの「精神病理学原論」を読んでいて眠くなったと回想しています(戦争中、暇にまかせてあらためて読んだら感心したところがあったそうですが)。臺は精神病が生物学的変異によって生ずるものだと固く信じ、それを科学的に解明しようとしました。友人からは精神科より理学部が似合っていると評されたようですし、患者さんからは治療者ではなく「好奇心の塊」だと言われたそうです。しかし、この「好奇心の塊」によって研究上の業績を積み上げ、そのこともあってでしょう、群馬大学精神科教授に選出されます。
群馬大学でも、精神科病棟の開放に取り組み、患者が「いつ、退院させてくれますか」と訴えるのではなく、「退院したらどうしよう」と考えるような診療体制を臺教授は作り上げていこうとしました。さらに、統合失調症の経年的変化の長期観察を開始、症状の再発を抑えるための年次計画を立案しています。その一方で、慢性覚醒剤中毒マウスを分裂病のモデルにして行動学的手法で向精神薬の作用を検討し、群馬大学に行動医学研究所が設立されるきっかけを作っています。こうした活躍が評価されたのでしょう、1965年に東大教授に推挙されます。群馬大学において診療、研究両面で充実していた臺は東大教授にあまり魅力を感じなかったようです。しかし、さまざまな事情が絡んで、やむなく、移ることを了承します。このように、臺は「白い巨塔」の財前五郎のように東大精神科医局の徒弟制度の中で叩きあげて教授の座をつかみ取った人ではありませんでした。東大の医局にはごくわずかしか在籍しておらず、外部から横滑りで教授になったようなもので、東京大学精神科の医局講座制の中心に居座る存在などとは自分では思っていなかったでしょう。
しかし、精医連にとって臺東大教授は医局講座制の頂点に君臨する反動的人間にしかみえなかったようです。
安田講堂陥落の翌年、1969年9月、突然、精医連は赤煉瓦と呼ばれていた精神科病棟を占拠します。正しい治療ができるのは自分たちだけだと主張、臺教授以下、精医連に反対する精神科職員を病棟、検査室、研究室から力ずくで追い出してしまったのです。安田講堂と違い、病棟には患者がいました。患者のことを考えると、機動隊を導入して精医連を排除することは容易ではありません。臺教授を含めた精医連以外の教室員は外来診療を主として行うことになり、この後20年以上にわたって両者のにらみ合いが続くことになります。精医連(赤煉瓦派と呼ばれるようになります)の理論的主柱だった森山は「医局講座制のもとで教授による医師支配体制が研究至上主義によって貫かれながら、民間精神病院に寄生しつつ支配する抑圧的精神医療と構造的に結びついている」と主張していました。そこで、「諸悪の根源」である講座制をなんとしてでも解体しなくてはならないというのです。では、講座制を真に解体せしめるにはどうしたいいかというと「告発者が大学を去るのでは問題はまったく始まらない。なぜなら、真の解体とは、内部解体でしかありえないのだから」。ということで、大学に居続ける中から徹底的に大学講座制の悪弊を告発し続け「患者の犠牲による医学の進歩」なる虚妄な幻想を廃し、目の前の一人一人の患者の苦悩と真に関わり合うために病棟を占拠し、「自主管理」することにしたというのです。しかし、臺は「医局講座制は正直の所非難されるべき多くの欠点をもっていたにしても、その欠点は社会基盤に由来し、また攻撃している医局員の意識構造の中にも制度を支える構えが備わっていた……権威に楯突くものは、権威をありがたがるものと同様に、権威にこだわりやすい権威志向的な人であることが多い」と感想を漏らしています。
精医連は医局講座制のみならず精神医療も問題視していました。そして、治療については電気ショック療法とか精神外科は論外であり、(薬物による)再理性化とか(作業療法のような)労働の強制によるのではなく、患者の自然治癒力を阻む要因を除去することによってなされるべきであると主張していました。いうまでもなく、反精神医学の影響が色濃い主張です。反精神医学について臺は「日本では、時代遅れの精神衛生体制のもとに、私立精神病院中心で経営上に患者を商品化することを免れなかったから、精神病院スキャンダルが頻発し、反精神医学は精神科医療の脆弱性、反医療性を直撃することができ」「反体制的な嗜好をもつ若い精神科医たちは、新鮮な理論として反精神医学に飛びつき、体制派の教授たち、院長たちを攻撃する武器として使おうとしたようだ」と解説しています。そして「体制側は弱みを抱えているので、批判に十分な対応を果たすことができなかった。その結果、物心両面で患者にも医療者にも大きな不幸がもたらされた」と述懐しています。
森山はさらに「『臨床医学』は、施療院の場で、施療患者を対象とすることによって、そしてそれによってのみ、成立したのであった。ここには、『貧困者に対する慈善は金持ちに適用されうる知識に代わる』」という文章をフーコーの「臨床医学の誕生」から引用して医学研究を攻撃しています。これが先程の「研究至上主義による抑圧的精神医療」「患者の犠牲による医学の進歩なる虚妄」という言葉につながるわけで、「特定の仮説に基づき、特定の侵襲を加え、対照群との比較のもとに、結果がよければ仮説が検証されたことになる、という「実験主義」」が主流となり、「『科学の進歩」の美名のもとに、多大の犠牲者を切り捨てることが許されるという倒錯した科学至上主義が、大学講座制の権威を背景に治療面にもばっこ』するようになり、「人体実験的治療」時代が始まったと断言しました。そして、精神医学研究は医局講座制度を支えるべく行われているだけで、患者には役立っておらず、しかも、これが精神医療全体を歪めている、と主張しました。どうやら、この主張が最終的に「臺ロボトミー人体実験」告発へとつながっていったようです。しかし、これに対し臺は「近頃、精神科医の一部に、いまどき研究などするのは反医療的だという声を聞く。私はかれらのいらだちに一応の共感を持つことを否定しないが、その独善的で性急な態度はかえって医療を荒廃させるものであることを指摘したい(臺弘 1972)」と書いています。
いつ機動隊が赤煉瓦病棟に攻め込んでくるかもしれないという危機感から東大精医連は大学の外へも活動の場を拡げました。
狙いを定めたのは精神医療が関係する諸学会、とりわけ、精神科医が中心となっている精神神経学会でした。ここでもかれらは権威の枠組みである学会を解体しようともくろみました。そして、やはり、「真の解体とは、内部解体でしかありえ」ませんでした。
臺教授はその精神神経学会の理事長に東大教授就任と同時に選出されていました。理事長となった臺がとりわけ力を入れたのが認定医制度の創設でした。当時の私立精神病院の惨状を何とかするためには、まず、専門性をあげ、精神科医全体のレベルを向上させる必要があると考えたのです。そこで、学会で認定医検討委員会を立ち上げ、アンケート調査を行い、「我が国における精神医療の将来の発展と質的向上のためには、十分な訓練を受け熟練した精神科医の育成が不可欠の要請である。本学会は精神科育成のための具体的な経過を立案し、認定医制度実施のための準備を進め、具体的内容を十分検討した上で、その発足の時期を総会にはかって決定する」という「認定医制度に関する理事長提案」を作成しました。この提案は理事会で可決され、長崎で開かれた学会総会の評議員会でも提案され、承認されました。しかし、承認されたのは学園紛争が真っ盛りだった1968年のことです。学会内には精医連を中心として反権威主義の熱気が押し寄せてきていました。若手医師評議員が中心になって認定医制度創設に猛烈に反対しました。教授や精神病院幹部が自分たちの権益を守るために医師を序列化する制度をでっちあげようとしている、というのです。これに対し臺理事長は「認定医制度は万能ではない。これを採用したら必ずよいことがあるという保証もない。悪用すれば悪いことだらけになる。認定医制度が有意義であるという保障は、一にかかってこの制度をうまく活用して精神医療の改善を促進しようという私どもの熱意と知恵と学会の民主的な運営にあるばかりである」と説明していました。しかし、臺理事長提案は学会全体の承認を得ることができず、結論は翌年の学会総会に持ち越されました。
しかし、翌年1969年に開かれた金沢学会では、東京大学のみならず京都大学をはじめとする関西の精医連も加わって若手学会員が学会執行部をつるし上げ、認定医制度どころではなくなりました。きっかけは総会開催資金が製薬会社、関連病院の寄附、そして、教室員の強制寄附から成り立っているという金沢大学精神科医局員による内部告発でした。これにかんする議論から旧来の学会運営に対する批判がなされ、学会理事会、評議員会の否認決議へと発展、通常の会長講演、特別講演、一般演題など学術講演はすべてキャンセルされました。代わりに、日本の精神科医療の問題、医局講座制、私立精神病院不祥事にかんして激しい議論が繰り広げられ、最終的に理事会不信任、評議員会の解散が決議され「学会は製薬資本、関連病院の寄附や金沢大学医学部神経精神医学教室員の犠牲の上に立って行われてきた。このような従来の慣習は精神医療、精神医学のあり方を歪めるものであったことを反省し、今後は学会員の負担によって運営される」という決議が採択されました。それまでの学会運営に製薬会社の関与をはじめとして不透明な部分があったことは否定できず、臺理事長以下学会幹部は精医連の批判になすすべもなく押し黙るしかなかったようです。この騒動の中で、臺の認定医制度創設案は消し飛んでしまいました。
この金沢学会の騒ぎは児童精神医学会、病院精神医学会、日本精神病理・精神療法学会、日本臨床心理学会など精神医学関連学会にも飛び火しました。心理学や教育学も巻き込んだ広い領域の学会で、従来の記念講演、シンポジウム、学術研究発表が停止され、精医連などの急進派学会員が主導するさまざまな討論の場に切り替えられ、学会機能を問い直すことが主張されました。騒然とした混乱の中、執行部が退陣したり、学会そのものの解散要求がだされたりする学会もありました。
そして、震源地の精神神経学会では1979年まで10年以上、総会における学術研究発表は中止となり、学会のあり方をめぐって全共闘運動の延長の場と化しました。そうした中、1971年精神神経学会で精医連委員長石川清が保坂秀夫学会理事長に20年以上前に臺が書いて精神神経学会誌に掲載されたロボトミー手術時採取された脳組織の検討に関する論文を生体実験と判断するか、このような「実験」が行われ、論文として学会誌に掲載された責任は、誰がどのようにしてとるかなど、五項目の質問と要求を提出、さらに、『前理事長臺弘氏を全学会員に告発する』という文書を作成し、その公表を求めました。この告発文はマスコミにも公表されました。しかし、精医連が過激な行動を背景に学会へ影響力を及ぼしていたとはいえ、いくらなんでも、それだけでこの告発を学会として受理することはできなかったようです。この問題を討議する「臺委員会」が設立され議論がなされましたが、結論は2年後に持ち越されます。そして、その2年後に名古屋で開かれた1973年の総会は荒れに荒れ、前日の評議員会から紛糾、非学会員も含む多数の傍聴者にとり囲まれ、ヤジと怒号が飛び交う異常な雰囲気の中で行われました。暴力行為までみられたようです。
以上の経過を見ると、この臺教授の告発は医学講座制と医学研究の頂点に立ち、自分たちの勢力と対立する人物を攻撃することが目的で、「ロボトミー人体実験」はそのための理屈づけにすぎなかったようにみえます。このロボトミー問題を検討する「臺委員会」では、被害の医学的事実を調査しようと提案もなされましたが、「不毛な実証主義」という罵声が浴びせられました。過去の精神外科の医学的検証、それが無理なら、当時細々と行われていた定位脳手術による精神外科の効果、副反応も含めた総合的医学評価をすべきはずだったのですが、行われた気配がありません。退潮傾向にあったとはいえ、熱にうなされたような反権力闘争集団の中でそんなことを提案しようものなら、上に挙げた反医学研究主張を盾に「似非科学主義反対!!」という扇動的野次(シュプレヒコール)が返ってきたのかもしれません。70年代前後の反権力闘争の時代にはそうしたことがまかり通っていたようです。
さらに、精医連はマスコミへの宣伝工作にも余念がありませんでした。1971年に臺告発が行われる直前、臺教授は面識のあった朝日新聞記者から電話でロボトミー手術の時に脳の組織をとって実験したかと非難がましい口調で聞かれたようです。これに対して「それはそうだが、どうかしたのか」とぶっきらぼうに答えたようですが、臺には、朝日新聞とのこのエピソードが『臺人体実験』問題の発端と意識されていたようです。
こうした嵐の中でなんとかうまく立ち振る舞うのに、臺教授ほど不適切な人物もなかったようです。すぐれた業績をあげる人にときにみられることですが、どうも、臺弘という人はついつい人の神経を逆なでするようなことをしたり、言ったりして恨みをかってしまう傾向があったようです。その個人的な恨みが、案外、告発の根本原因の一つだったのかもしれません。臺自身「私には、人情の機微を察する能力が欠けていて、自分のよいとする判断は相手にも通ずると思ってしまうので、時々苦い思いをすることがあった……わが妻が『あなたのように他人の心の分からない人に、よく精神科の医者が勤まりますね』と言ったのは、彼女も私の独りよがりに困らされたことが何度もあったからであろう」と述懐し「個人的な怨念は時に正義の仮面をかぶることがある。正義のためにのぼせ上がっている人たちを相手にするのはまったく楽ではなかった」と振り返っています。さらに臺は「大東亜戦争の例で判るように、『天に代わりて不義を撃つ』となったら、まずはまやかしとみて間違いないだろう」とも書いてもいます。同じようなことを頭に血が上っている医局員、学生、活動家の前でついうっかりいってしまったのかもしれません。若い頃に社会主義に傾倒し、警察に逮捕されて留置所生活を体験、その後、戦争で生死の境をさまよった人間には、全共闘たち活動家は戦前の過激愛国主義者と同類にみえていたかもしれません。しかし、「頭に血が上っている」活動家たちには、医局講座制と学会の頂点に君臨する東大教授は戦争に協力し従軍した古い世代の反動的人物としかみえていなかったようです。
禁忌としてのロボトミー
いずれにしても、こうして、最終的に、日本では精神外科は禁忌となりました。そして、この禁忌を守らせるために精医連などの活動家が各地の脳神経外科手術を監視し、過激な手段で封じ込めようとしました。たとえば、1973年、定位脳手術を用いて精神外科を行っていた東京大学脳神経外科の佐野圭司教授は活動家に支援された家族によって人権侵害で訴えられます。さらに、翌年には、佐野教授が会長を務めた国際脳外科学会に過激派精神科医集団が押し寄せてきて学会を大混乱に陥れました(この学会には米国脳神経学会の代表として例のスコヴィルも招待されていたようです)。その後、佐野は精神外科に関する「公開討論会」なるものに引きずり出されて、つるし上げを喰らい、精神外科を今後一切行わないという確約書にサインをさせられています。さらに、この前後、精医連などの活動家集団の後押しの下、精神外科による後遺症の医療補償を求める患者さんとご家族による訴訟が何件もなされ、多くが賠償和解に至っています。矛先はさらに手塚治虫の「ブラック・ジャック」にまで及びました。1977年1月1日号の「週刊少年チャンピオン」に掲載された「ブラック・ジャック第153話『ある監督の記録』」には脳性麻痺児への「ロボトミー手術」が描かれていたようで、これが障害者を使ってロボトミーを美化するものだと障害者団体と精医連から非難されたのです。手塚と出版社は新聞に謝罪広告を出して陳謝し、この「ある監督の記録」は題名とストーリーを変更して単行本に収録されました(改変前の漫画が手に入らず確認できませんが、実際には、ブラック・ジャックはロボトミー手術ではなく定位脳手術による電気刺激治療を行ったように描かれていたようです。ところが、どうやら、手塚が勘違いしてこれをロボトミー手術と記載してしまった、というのが実情のようです(プレミアムごま https://premium-goma.com/blackjack-kairakunoza/)。
そうした中、ついには、精神外科に関連する殺人事件まで起きます。暴力事件を起こし精神病質と診断され前帯状回切除術をうけた男が、手術から15年目に、自分の意欲の減退は精神外科手術を受けさせた主治医のせいだと恨み、殺人目的で主治医の家に押し入ったのです。しかし、主治医は不在で、妻と義母が殺害されました。1979年のことです。
こうして日本には精神外科をやろうとする人間はいなくなり、ロボトミーは、けっして触れてはならぬ不浄のタブーとなりました。
日本におけるてんかん外科の苦難の歴史
そして、てんかん外科治療がそのあおりをくうことになります。1970年代以降、ロボトミーと混同され、てんかん外科治療にとって、肩身が狭い、逃げ隠れを余儀なくされる時代がしばらく続くことになったのです。
理論的仮説を基盤として行われた精神外科手術と違い、てんかん外科手術は神経細胞の異常興奮によって生じるという明確なてんかん発作の病態生理に基づいて行われます。手術に際して、脳波、画像診断という客観的指標があり、さらに、和田テストのような神経心理検査法によって手術による欠落症状を最小限に抑える体制も整っています。にもかかわらず、精神外科とてんかん外科は混同視され、学園紛争の余波が残る1970年代、てんかん外科手術を行おうものなら佐野圭司のときのように「活動家」が押しかけてきかねない空気が漂っていました。明らかな「病変」のない脳を切り取るとなれば、ロボトミーだろうが側頭葉切除だろうがお構いなし、問答無用で、吊し上げの対象になりかねなかったのです。
こうした状況の中、てんかん外科を何とかして日本で再興しようと1978年にてんかん外科の研究会が結成されました。しかし、吊し上げを恐れ、当分の間てんかん外科の名前は表に出さないことになりました。代わりに「ペンフィールド記念懇話会」なる名前が冠されました。この研究会が「日本てんかん外科研究会」という本来の名称に変更されたのは20年後の1997年のことです。1991年に日本てんかん学会で久しぶりにてんかん外科がシンポジウムに取り上げられることになったときも、てんかん外科に反対する「活動家グループ」が押しかけてくるのを恐れ、時の学会会長は会場警備を強化しました。
ビデオ脳波同時記録を含めた先進的なてんかん診療体制を確立していた静岡てんかんセンターでは、1983年に三原忠紘先生を中心としたグループがてんかん外科治療を開始、これが日本におけるてんかん外科治療再開の実質的な口火を切った動きの一つと考えられています。三原先生は元々緩和外科の効果に疑問を抱いてみえたようで、そのためでしょう、敢えて、ロボトミーととられかねない切除術を主体にてんかん外科手術を開始、2001年までの20年間に脳葉切除を357例行いました。このうち、側頭葉てんかんの発作消失(エンゲルのクラスI)率は78%に達しており、これは欧米の先進施設に勝るとも劣らない成績です。切除術357例の内訳を見ると、側頭葉切除が282例だったのに対し、側頭葉以外の切除が75例で、側頭葉切除が圧倒的多数を占めています。とくに、初期の頃は気脳断層撮影で海馬萎縮を確認、頭蓋脳波とビデオで10回以上複雑部分発作を記録した側頭葉内側硬化が疑われる症例で側頭葉切除ばかりをやっていたようです。これは、欧米での評価が定まっており、海馬硬化という「明確な病変」があり、術後予後のよい側頭葉切除に限定して行っていたようにもみえます。隙を見せず、再び歩き始めたばかりの日本のてんかん外科治療が吊し上げを喰らって頓挫することがないよう用心していたのでしょう。「1990年頃になってもてんかん外科に対する空気は冷たいように思われ、西の評議会、東の精医連の動向を気にしながら、著効が得られそうな症例に限定し”てんかんの包括的医療としての外科治療”という旗印を掲げて、その必要性を訴えていた」と三原先生はのちに語ってみえます(国立病院機構(NHO)静岡てんかん・神経医療センター漆山会発行漆山会誌第35巻p28-31(2025))。
静岡てんかんセンターをトップランナーとして、1980年半ば以降、日本でも各地で有能な脳神経外科医が切除手術を含めたてんかん外科治療を再開しました。てんかん外科治療を行うためには、前にも述べましたように、てんかんの診断、治療、福祉的支援など総合的に患者さんに対応する力が要求されます。このため、てんかん外科治療の拡大に伴って、日本各地でてんかん診療の中核センターが設立されていきました。そして、これに連動し「てんかんのある方が地域で適切な支援が受けられるよう、てんかん診療の地域連携・ネットワークを構築し、全国で均一なてんかん診療を行える体制を整備する事業」が厚生労働省の音頭のもと、始められました。地域の人々への啓発活動、てんかんのある方やそのご家族への相談支援体制の構築、医療従事者への情報提供、研修を行うことになっていますが、その中心となるのが各地域におけるてんかん診療の中核センターで、地域てんかん診療拠点としてさらなる整備がなされる予定です。
エンゲルは「第二次世界大戦後、数十年間にわたり日本とドイツではてんかん外科が禁止されていた」と書いています(Engel JJ (2019))。しかし、これはエンゲルの思い違いでしょう。前に言いましたように、戦後まもなく日本では精神外科が盛んに行われるようになりましたが、それと並行しててんかん外科治療も行われています。しかし、てんかん外科以外の分野ではてんかんに関する英文論文を盛んに発表していた日本から、てんかん外科に関してだけは1990年代までほとんど目立った英文報告がありませんでした。精神外科が禁忌となって、そのあおりを喰らって、てんかん外科もしばらくできなくなってしまったためです。このため、エンゲルは日本でてんかん外科が禁止になったと誤解したのかもしれません。てんかんの症候論や薬物療法では世界のトップランナーの一つだったドイツも、たしかに、同時期、てんかん外科については沈黙を保っているようにみえました。その理由についてはよく分かりません。もしかしたら、エンゲルが日本とドイツを並べたのは、第2次世界大戦中の九州大学のアメリカ兵捕虜への生体実験とナチスのユダヤ人への生体実験が念頭にあったのかもしれません。てんかん外科が生体実験と勘違いされたのではないかとエンゲルが疑った可能性もあります。ロボトミーとの関連からいえば当たらずといえども遠からずといえるのかもしれません。
いずれにしても、日本におけるてんかん外科は欧米に比べ立ち遅れることになってしまいました。しかし、現在、量はともかく、質は世界レベルに達し、全国で高水準のてんかん外科治療が行われています。
飢餓状態になると、てんかん発作がおさまることがあります。
このことはかなり昔から知られていました。
古代ギリシャのヒポクラテス全集では絶食がてんかんの唯一の治療法とされていますし、やや時代が下がって、新約聖書時代にも、断食は祈りと並んでてんかん発作の重要な治療法とみなされていたようです。
<マタイ福音書17章14-21節 (フランシスコ会聖書研究所訳)>
「14 彼らが群衆のところに来ると、1人の人がイエズスに近づき、ひざまずいて、15 言った。「主よ、わたしの子をあわれんでください。ひどいてんかん持ちで、たびたび火の中や水の中に倒れます。16 それで、お弟子たちのところにつれて来ましたが、彼らにはいやすことができませんでした」。17 イエズスは答えて、「ああ、不信仰な、邪悪な時代だ。わたしはいつまであなたがたとともにおればよいのか。いつまであなたがたに辛抱しなければならないのか。その子をここに連れて来なさい」と言われた。18 イエズスがおしかりになると、悪魔はその子から出て行った。そのときから子どもはよくなった。19 弟子たちは自分たちだけになったとき、イエズスに近づいて、「どうして私たちには追い出せなかったのでしょうか」と尋ねた。20 イエズスは仰せになった。「信仰が薄いからである。あなたたちによく言っておく。もし、あなたたちに一粒のからし種ほどの信仰があれば、この山に向かって、『ここからあそこに移れ』と言えば、山は移るだろう。信仰があれば、あなたたちにできないことは何もない。21( しかし、この類のものを追い出すには、祈りと断食によらなければならない)」
この最後の節21が絶食によっててんかん発作が抑制されることを(福音書が書かれた)1世紀末期の人間が知っていた証拠とされています。ただし、この取ってつけたような文章は以前から問題視されているようです。マタイ福音書(または、その基になったマルコ福音書9章17節)の原典に、のちになって何者かが付け加えた文章ではないかと疑われているのです。このため、聖書によってはこの文章が削除されています。少なくとも、日本の聖書では文語訳でも口語訳でも省略を示す記号を付けたうえで、文章21は省かれていることが多いようです。しかし、アメリカの聖書では削除されていない場合が結構あるようで(7-21 Howbeit this kind goeth not out but by prayer and fasting)、ケトン食療法に関するアメリカのテキストブックや総説では「飢餓がてんかん発作を低減させることは聖書の時代から知られていた」という文章が散見されます。

| 図23ラファエロ・サンティ 「キリストの変容」 https://www.musey.net/wp-content/uploads/2017/06/the-transfiguration-1520Large.jpg 右下で目を吊り上げ、右手を振り上げ、左手を捻って拡げ、全身が捻転硬直して緑色の服の男(父親?)に体を支えられている少年がマタイ福音書17章の「火の中や水の中で倒れ」る子どもを描いていると考えられる。 |
しかし、飢餓状態を続けることによっててんかんを治すことはさすがにできませんでした。
ところが、20世紀に入って飢餓状態をてんかん治療に役立てようとする試みがはじまります。1911年、4日間飢餓状態におかれた20名のてんかん患者で発作コントロールが得られたという報告が、まず、フランスでなされました (Guelpa G, Marie A(1911) La lutte contre L’epilepsie par la desintoxication et par la reeducation alimentaire. Revue de Therapie Medico-Chirugicale 78:8-13)。しかし、いつまでも絶食を続けるわけにはいきませんから、この観察結果をそのまま治療に結びつけることはできませんでした。ところが、10年後の1921年、飢餓によるてんかん発作抑制状態が体内のケトン体形成に関連していることが米国のGeyelinによって報告されます(Geyelin HR (1921) Fasting as a method for treating epilepsy. Med Rec 99:1037-9)。そして、同年、やはり米国のミネソタ州ロチェスター市にあるメイヨークリニックのWilderが飢餓状態と同等の効果を高脂肪食によってえられることをてんかん患者において示し、この高脂肪食をケトン食 ketogenic dietと名づけました(Wilder RM. Effects of ketonuria on the course of epilepsy. Mayo Clin Bull 1921;2:307-14)。
私たちの体は主としてブドウ糖をエネルギー源にしています。このため、血液中のブドウ糖、血糖の濃度が一定に保たれるよう、私たちの体はさまざまな方法で調整しています。たとえば、1ー2食抜いてブドウ糖の供給を絶っても、肝臓に蓄積されているグリコーゲンがブドウ糖に分解されて血液に放出され、血糖濃度が保たれます。ところが、飢餓状態が続き、肝臓のグリコーゲンまで枯渇すると、エネルギー供給をブドウ糖に頼れなくなります。すると、こんどは、脂肪組織の分解が始まります。脂肪から脂肪酸が産生され、この脂肪酸がブドウ糖に代わって骨格筋、心筋などのエネルギー源として活用されるようになるのです。骨格筋、心筋でエネルギーとして使われたあと、脂肪酸は二酸化炭素と水に分解され、体外に排泄されます。一方、肝臓では脂肪酸分解の過程でアセト酢酸、3-ヒドロキシ酪酸、アセトンが産生されます。この3つの代謝産物はケトン体と総称され、脂肪酸同様、エネルギー産生に活用できます。とりわけ脳は脂肪酸をエネルギー源として使うことができないので、ブドウ糖が不足するとケトン体だけが頼りです。このためもあって、飢餓状態では肝臓の脂肪酸が分解され、盛んにケトン体が作成されます。
しかし、飢餓状態でなくともケトン体産生が増えることがあります。炭水化物を制限して、脂肪を大量に摂取した時です。食事内容がそのような偏った状態になると生体は脂肪を手っ取り早くエネルギー源として使おうとするので、やはり、ケトン体産生が増えるのです。
Wilderはここに目をつけました。
てんかん発作に対する絶食効果のもととなっているケトン体を低炭水化物-高脂肪食で人為的に増加させることを考えたのです。そして、食事の脂肪にたいする炭水化物とタンパク質を合計した重量(グラム)比(Wilderはこれをケトン比と名づけました)を2:1にすると体内にケトン体が産生されはじめ、3:1以上とすれば、持続して確実にケトン体が生成されることをみつけました。
高脂肪、低炭水化物(+適量タンパク質)のこうした食事(ケトン比4:1)を用いたてんかん食事治療は、ケトン食療法と命名されました。このケトン食療法はさまざまなてんかん発作に効果を示し、日本を含め世界中で試みられました。
Wilderの時代にケトン食療法が盛んに行われたのには理由がありました。1920年代といえば、まだ臭化カリウム・ナトリウム(ブロム)とフェノバルビタールぐらいしか抗てんかん薬がなかった時代です。この2つの薬のおかげでてんかん発作がかなりコントロールされるようになったとはいえ、まるっきり効かない発作も少なくありませんでした。その代表が欠神発作です。そして、ケトン食は、欠神発作に絶大な効果を示したのです。
実際、ケトン食療法がおこなわれるようになった頃の主要目標発作は欠神発作でした。欠神発作は過呼吸によって誘発されることはよく知られています。過呼吸になると、肺からの二酸化炭素の排泄が促進されます。すると、身体はアルカリ性に傾きます。つまり、体がアルカリ性に傾くと、欠神発作が出やすくなるわけです。そこで、逆に、ケトン体で酸性に傾けると発作が静まるのではないかという仮説がたてられました。その仮説が正しかったのかどうか、じつは、よくわからないのですが、ともかくも、ケトン食によって多くの症例で欠神発作が消失しました。
そして、その後、過呼吸によって発作が誘発されるわけではない強直発作、てんかん性スパズム、ミオクロニー発作でもケトン食療法が効果を発揮することが判明しました。抗てんかん薬の種類が少ない時代を後から振り返って集計した結果ですが、ケトン食によって1000例中52%で発作が消失し、27%で発作が改善したという報告が残されています。
ところが、フェニトインという強力な抗てんかん薬の出現とともに、ケトン食療法への情熱は冷めはじめます。そして、エトサクシミド、バルプロ酸といった欠神発作にも効く新たな抗てんかん薬が開発されると、ケトン食療法はほとんどおこなわれなくなりました。とくに、欠神発作にもミオクロニー発作にも全身けいれんにも効果を発揮する分枝鎖脂肪酸のバルプロ酸の出現は決定的で、もはやケトン食療法はてんかんに対する正統的な治療法とはいえないと主張するてんかん学者まで現れました。
一日数回薬を服用すればすむ薬物療法に比べ、ケトン食療法はあまりに煩雑で、患者さんに苦痛を強いるものでした。
初期のケトン食療法では、まず、最低1カ月の入院が必要とされました。ケトン食は、かなり特殊な食事ですから、作り方を患者さん(もしくは保護者の方)に時間をかけて覚えていただく必要があります。さらに、ケトン食開始時には身体が酸性に傾いたり(ケトアシドーシス)、嘔吐、低血糖、脱水、下痢、頑固な便秘などの副作用がでたりするので、落ち着くまでは、身体のさまざまな面を厳重にモニターし、副作用がでたら、すぐさま対処する必要がありました。
入院すると、まず、尿中にケトンがでてくるまで絶食です。そして、これに耐えても、ようやくありつける食事は油だらけ。甘いものは厳禁。これを最低2年以上続ける必要があります。当然、多くの患者さん(と保護者の方)はこれに耐えられず、脱落者が続出しました。
こうして、1970年代には、ウェスト症候群のてんかん性攣縮発作など一部の小児難治てんかん発作をのぞいて、ケトン食療法はほとんど行われなくなります。1972年に発刊された和田豊治先生の「臨床てんかん学」にも「抗てんかん剤が発達した現在でも前述のように本ケトン食治療が難治の頻発例に時におこなわれることがあるが、しかしその実施は患者の忍耐という点でも経済的にもきわめて困難であって、親も子もともに疲れはてて中止することが多いので本治療は簡単に考えておこなわれるべきものでない」 と書かれています。どうにもならなくなったとき、あまり期待もせず、とりあえず、やってみる治療、それが、当時のケトン食療法の位置づけでした。このため、きちんとケトン食の献立を作ることのできる熟練栄養士もいなくなり、ケトン食療法はほとんど忘れ去られた存在になってしまいました。
ところが、1990年代初頭、ケトン食療法はアメリカで息を吹き返します。
きっかけは、NBCテレビの人気番組「Dateline(日付変更線)」でした。1994年、この番組でケトン食療法がとりあげられ、全米で放映されました。そして、チャーリー・アブラハムズという生後20か月の男の子にみられたケトン食療法の奇跡的な効果が視聴者の注目を浴びました。抗てんかん薬治療でも外科治療でもおさまらなかった発作がケトン食療法で完全に消失、精神活動も活発になったチャーリーの姿がテレビ画面に映し出されたのです(チャーリー少年は15年後に開催された第一回ケトン食療法世界会議に招待され、ゲストスピーカーとして講演をしています)。チャーリーがケトン食療法を受けたジョンズ・ホプキンス大学小児てんかんセンターには5000件以上の問い合わせが殺到、ケトン食療法の認知度は一気に高まりました。
さらに、チャーリーの父親はケトン食療法の普及を目指して「チャーリー財団」を設立、ケトン食療法にかんする研究活動を支援しました。また、ケトン食療法を啓蒙するために、患者、医師、栄養士向けにケトン食に関するパンフレット、ビデオをアメリカ中に配布、ケトン食療法に関する書籍 “てんかん食事療法:ケトン食入門 The Epilepsy Diet Treatment: The Introduction to the Ketogenic Diet (Freeman et al, 1994) ” の出版も支援しました。その上、ケトン食を取り扱ったメリル・ストリープ主演のテレビドラマ「誤診 First Do No Harm」を制作しています。
中でも大きかったのはケトン食に手慣れた9カ国のてんかん学者と栄養学者からなる有識者会議(パネル)結成(2006年)に財団が財政的支援をしたことでした。このパネルは国際ケトン食検討グループを結成、それまで断片的発表されてきたケトン食の報告をまとめ、グループの構成員の経験もまじえ、ケトン食の対象、実施方法などに関するガイドラインを作成して、てんかんにかんしてもっとも権威ある雑誌エピレシアに発表しました(Kossoff EH et al (2008)Optimal clinical management of children receiving the ketogenic diet: Recommendations of the International Ketogenic Diet Study Group. Epilepsia 50:304-17)。これによって、ケトン食に関する国際的な指針が一応できあがりました。10年後、この指針は改定がなされています(Kossof EH et al (2018) Optimal clinical management of children receiving dietary therapies for epilepsy: Updated recommendations of the International Ketogenic Diet Study Group Epilepsia Open, 3(2):175–192 (2020年12月閲覧))。以下の表はこの改訂版に準拠しています。
| 表11 ケトン食の適応 | |
| ケトン食が特に有用と報告されているてんかん症候群および疾患 | ケトン食が禁忌とされる疾患および病態 |
| ケトン食の平均有効(50%以上の発作抑制)率である50%を超え70%以上の効果が常に報告されている症候群、疾患 糖輸送担体1異常症(GLUT1欠乏症) ピルビン酸脱水素酵素複合体欠損症 複合体1ミトコンドリア疾患 ミオクロニー失立てんかん(失立発作てんかん)(ドーゼ症候群) 大田原症候群 乳児攣縮(ウェスト症候群) 重症乳児ミオクロニーてんかん(ドラベ症候群) 有熱性感染関連てんかん症候群 結節性硬化症 レット症候群 ミルク(のみ)を飲んでいる子ども、乳児 中等度の有用性(ケトン食の平均有効率を上回らない、もしくは、限られた症例報告のみ)が報告されている疾患 アデニロスクシナーゼ欠損症 糖原病V型 レット症候群 CDKL5脳症(早期乳児てんかん性脳症2) 遊走性焦点発作を伴う乳児てんかん 小児欠神てんかん 徐波睡眠期持続性棘徐波を示すてんかん性脳症 ランドー・クレフナー症候群 レノックス・ガストー症候群 若年性ミオクロニーてんかん 皮質形成異常 ホスホフルクトキナーゼ欠損症(糖原病VII型 垂井病) 亜急性硬化性全脳炎(SSPE) ラフォラ(Lafora)病 | 絶対的禁忌 カルニチン欠損症(原発性) カルニチンパルミトイルトランスフェラーゼI、II欠損症 カルニチントランスロカーゼ欠損症 β酸化欠損症 中鎖アシルCoA脱水素酵素欠損症 長鎖アシルCoA脱水素酵素欠損症 短鎖アシルCoA脱水素酵素欠損症 長鎖3-ヒドロキシアシルCoA欠損症 中鎖3-ヒドロキアシルCoA欠損症 ピルビン酸カルボキシラーゼ欠損症 ポルフィリア 相対的禁忌 十分な栄養を保てない状態 外科的切除可能焦点が神経画像、ビデオ脳波記録で判明している例 両親、保護者が指示に従えない例 |
| International Ketogenic Diet Study Group(2018)一部改変 | |
| 表12 ケトン食の種類 | ||||
| ケトン食療法の種類 | 食事の概要 | 総エネルギー摂取量に占める 各栄養素の割合 | ||
| 脂肪 | 炭水化物 | タンパク質 | ||
| 古典的ケトン食 | ケトン比=3:1 ~ 4:1 | 90 | 4 | 6 |
| 古典的中鎖脂肪酸ケトン食 | 総エネルギーの60%を中鎖脂肪から摂取 | 70 – 75 | 15 – 18 | 10 |
| 修正中鎖脂肪酸ケトン食 | 総エネルギーの30%を中鎖脂肪から、30%を短鎖脂肪酸から摂取 | 70 – 75 | 15 – 18 | 10 |
| 修正アトキンズ食 | ケトン比=1:1~2:1 炭水化物を1日10g(小児、成人は15g)以下に制限するが、その後20g(小児、成人は30g)まで緩和 | 60 – 65 | 5 – 10 | 30 |
| 低グリセミック指数食 | 1日の炭水化物摂取量を40-60gに緩めるが炭水化物は低グリセミック指数食に限定 ケトン比=1:1 ケトン体産生の程度は問わない | 60 | 10 | 30 |
| ケトン比=脂質重量(g):(炭水化物+タンパク質)重量(g) どの方式においても栄養組成は患者の状態に応じて変更 International Ketogenic Diet Study Group(2008)一部改変 | ||||
こうして、NBCテレビの番組を境に、ケトン食療法を行う病院・施設がアメリカで急増し、ケトン食療法外来を開設する病院さえ現れました。これに比例して、年間数編程度にまで落ち込んでいたケトン食に関する英語論文も急増しました。そして、国際ケトン食検討グループによるガイドラインの発表も相まって、アメリカ以外でもカナダ、韓国を初めとして世界各地でケトン食療法が盛んに行われるようになりました。日本でも、てんかん診療の中核施設を中心に施行数が増え、たとえば、ケトン食用の特殊ミルク、ケトンフォーミュラ((株) 明治、817-B)の供給量が最近10年間で4.5倍に急増しています。
さらに、脳へのブドウ糖輸送に異常をきたし、空腹時、ふらつきやけいれんがみられるブドウ糖輸送担体1異常症(GLUT1欠乏症)という疾患の存在が認識されるようになり、この疾患の効果的な治療法としてもケトン食は脚光を浴びるようになりました。体調がすぐれないと血液脳関門をブドウ糖が超えられなくなって、脳がブドウ糖をエネルギーとしてうまく使えなくなる病気で、ケトン食にすると脳の神経細胞が必要時いつでもケトン体をエネルギーとして使えるようになるので、病状を落ち着かせることができます。同じことは、ピルビン酸脱水素酵素複合体欠乏症にもいえます。ブドウ糖をエネルギーとして使おうとすると問題が起きてしまう疾患で、ケトン食で産生されるケトン体でエネルギーを補完して症状をでにくくすることができます。さらに、細胞内のエネルギーを作りだすミトコンドリアの病気や糖代謝異常症である糖原病の一部でもケトン食の効果が報告されるようになってきました。
逆に、ケトン食は脂肪代謝機能に負荷をかけるので、脂肪代謝異常症ではケトン食は禁忌であることが治療指針に明記されました。
食事方法にも工夫が施されました。以前は早くケトン体を体内に作りだそうと、入院すると、すぐに数日絶食していたのですが、この絶食期間をなくし、ゆったりとケトン食を導入する方法に変わりました。
中鎖脂肪酸ケトン食
また、食事に含まれる脂質の中心をなしている長鎖脂肪酸に比べケトン体を効率的に誘導する中鎖脂肪酸(MCT)を脂質として使うMCTケトン食が考案されました (Huttenlocher PR et al (1971))。中鎖脂肪酸は長鎖脂肪酸よりも速く代謝され、重量あたりのケトン産生量も多くなるため、脂質に対する蛋白、炭水化物の重量比、いわゆるケトン比を1:1前後にまで下げてもケトンを十分作りだすことができることがあります。ケトン比が1:1であればタンパク質、炭水化物もかなりとることができ、ケトン比4:1の古典的ケトン食ほど脂っこくありません。かなり食べやすくなります。それに、体内の脂質異常も起こりにくくなり、成長への心配もあまりしなくてよくなります。微量元素などの栄養素の追加も少なくてすみます。それでいて、治療効果は古典的ケトン食と遜色ないことが無作為比較研究で確認されています。中鎖脂肪酸の含量が多いと(通常、食事カロリーの60%)下痢、嘔吐、鼓腸などの消化器症状が出やすくなりますが、その場合、最初は長鎖脂肪酸をある程度入れておいて(カロリー量として長鎖脂肪酸と中鎖脂肪酸を半々ぐらいにして)、その後、徐々に中鎖脂肪を増やしていくという工夫で乗り切ることができます。ただし、中鎖脂肪オイルが高価であること、肝不全の危険があるので慎重にバルプロ酸を投与する必要があること、などが問題となります。
修正アトキンズ食
さらに、脂肪、カロリー制限のないダイエット法として人気を博したアトキンズダイエットを応用したケトン食、修正アトキンズ食の効果が、偶然、発見され、臨床応用されるようになりました。ケトン食療法で入院予定の難治てんかん児のお母さんが、入院を待つ間、アトキンズダイエット食を参考に炭水化物を減らした食事を調理してお子さんに食べさせたところ、数日で発作が消失したのです。これが、この食事療法が導入されるきっかけになりました。
アトキンズダイエットは炭水化物を少なくしてタンパク質と脂肪にはとくに制限を加えず、これによってインシュリンの分泌を抑え、脂肪分解の促進を狙ったダイエット法です。当然、脂肪の分解によってケトン体が増加します。実際、発作が止まった時点でこの子の尿にはケトン体がでていました。ところが、この時のケトン比は古典的ケトン食よりも低い2:1だったのです。そこで、このお母さんが作った「ダイエット食」のレシピを参考に修正アトキンズ食療法が開始されました。そして、やはり、ケトン比が1:1前後でも発作が止まることがわかってきました。その上、古典的なケトン食に比べタンパク含有量が多く、やはり、比較的食べやすい献立が可能です。アトキンズ食が体重減少を目標としているのに対し、修正アトキンズ食の目指すのはケトン体の誘導ですので、アトキンズ食とは異なり、炭水化物制限は続行し、ケトン体が出るように脂肪摂取を増やします。タンパク質の摂取制限、カロリー制限、水分制限はしません。おかげで、従来のケトン食に比べると気を遣わなくてすみます。にもかかわず、修正アトキンズ食のてんかんに対する効果については(議論の的となっている元祖アトキンズ食のダイエット効果と異なり)かなりの有効例が報告されています。とくに、今まで食べづらくてケトン食を勧められなかった成人にも使えるようになったのは大きいと思われます。難治てんかんの成人の3割近くで50%以上の発作頻度減少がみられ、6%で発作が消失したという報告がなされています(Payne NE et al. (2011) )。古典的ケトン食に比べると発作改善率はやや劣るという報告もありますが、成人の場合、食べ続けてくれるのは修正アトキンズ食の方です。食べ続けなければ効果もでないのですから、有効率が少し劣っても修正アトキンズ食を、ということになるだろうと思います。
低グリセミック指数食療法
さらに低グリセミック指数食療法Low glycemic index treatment (LGIT)も開発されました。
グリセミック指数とはある食べ物を摂取したときの糖質の吸収度合いのことで、当該食品の摂取後2時間の血糖濃度を計測して、ブドウ糖を摂取したときの血糖濃度との対比で算出します。グリセミック指数が70以上の食品を高グリセミック指数食(白米、白パン、ジャガイモ、コーンフレーク、シリアル、グルコースなど)、指数56から69の食品を中グリセミック指数食(砂糖(グルコース+フルクトース)、サツマイモ、全粒粉製品など)、指数55以下の食品を低グリセミック指数食(野菜、果物、豆類、全粒穀物、フルクトース、ナッツ、低炭水化物製品など)と呼びます(ただし、食物繊維、脂肪などが付加されてもグリセミック指数は下がりますし、食品の粒子の大きさによっても指数は変化します)。2003年にWHOが「肥満、2型糖尿病の発症リスクを下げるかもしれない」という報告をして以来、低グリセミック指数食はダイエット、糖尿病関連で有名になっていました。
その低グリセミック指数食を用いたてんかん食事療法ですが、これも、患者さんの経験がヒントになって臨床応用が始まりました(Pfeifer, Thiele EA (2005))。
一日に40回以上発作が頻発していた思春期の2人の少年です。
ケトン食療法で2人とも発作頻度が90%以上減ったのですが、ケトン食の厳しい食事制限に耐えられず、ケトン食療法を断念することになりました。当然、ケトン食療法中止後、発作が頻発するようになりました。しかし、2人のうち1人の少年で発作頻度に波があることに気づかれました。炭水化物の多い食べ物をとると明らかに発作が多かったのです。そこで、この2人の少年に、通常のケトン食よりも多くの炭水化物の入った食事を許可しました。ただし、その炭水化物は血糖をほとんど上昇させない「低グリセミック指数」炭水化物に限定しました。すると、2人とも再び発作頻度が90%以上低下したのです。この結果を受けて始まったのが低グリセミック指数食療法です。
血糖の変動がてんかん発作と関係があることは以前から知られていました。
中鎖脂肪酸ケトン食を提唱したHuttenlockerは炭水化物制限の手をちょっとでも緩めると発作が再発することを指摘していました。さらに、古典的ケトン食療法の間は、絶食中も含め、血糖の変動が少ないことも知られていました。こうしたことから、ケトン食療法の効果は、ケトン体そのものに加え、血糖変動が抑えられることも一因ではないかとの仮説が立てられるようになっていました。血糖変動の減少によってインシュリン分泌が抑制され、それに伴って起きる代謝変動がてんかん発作抑制に絡んでいるのではないかというのです。この2人の少年はその仮説を証明しているようにみえました。
こうして2人の少年以外の患者さんにも低グリセミック指数食療法が行われました。そして、6か月以上この食事療法が行われた症例中6割で50%以上の発作頻度の減少を認め、4割近くで90%以上の発作頻度の減少を認めました。全般発作のみならず部分発作にも有効でした。そして、やはり、従来のケトン食に比べ、低グリセミック指数食は食べやすく、脱落者も少なくてすみました。ケトン食にくらべ制限が緩やかで、他の人とさほど変わらない食事を一緒に食べることができ、生活上孤立することも少ないからです。そして、調理も簡単で、入院して、厳密な栄養管理も必要とされないこともこの食事の利点として評価されました。
以上のような栄養組成の改変のみならず、メニューにも工夫が凝らされるようになりました。おやつ用に「ケトン食」チョコレートキャンディーなどが考案されました。日本ではケトンフォーミュラ(ケトン食療法用特殊ミルク)をもとにアイスクリームをつくることも行われています。
ケトン食の効果と副作用
こうしたさまざまな改良により、かなりの施設でケトン食療法がおこなわれるようになりました。そして、それとともに、対象症例も増え、効果についても良好な結果が示されるようになってきています。ケトン食による効果は、通常、2週間から4週間ぐらいで現れますが、数か月後にようやく発作が消失する患者さんも時にはみられるので、すぐに効果が現れなくても、4か月ぐらいは継続して試すべきだとされています。そして、そこまで食事療法が継続できれば、最近の集計では、乳幼児の場合、約6割の子で50%以上発作が減少し、3分の1の子で発作が消失するという結果がでています。
ただ、脱落例が多いせいでしょう、信頼性が高い二重盲検法による効果判定は、残念ながら、今までの所、どこの施設でもできていません。上に挙げたケトン食療法のどれが良いのか、あるいは、どのような症例(たとえば年齢)にはどの方式が良いのかについても十分に検討がなされていません。効果と副作用に関してはあまり差がなさそうですが、忍容性(継続可能性)の点では修正アトキンズ法がやや優れているようです。
ケトン食療法の効果は年齢、発作型、基礎疾患によって左右されることはないといわれています。しかし、発作型に関していえば、ウェスト症候群のてんかん性スパズムを対象として行われることが現在も多いようです。副作用が強く再発率も高いACTH療法と同等の発作消失効果があるとされているからです。これに対し、外科治療の対象となるような難治性部分発作の症例は対象から除外されています。また、てんかん類型別では、ミオクロニー失立てんかん(失立発作てんかん)、重症乳児ミオクロニーてんかんなども対象として推奨されています。基礎疾患としては、先ほど述べた糖輸送担体1異常症が適応の筆頭にあげられます。ケトン食療法がこの疾患で最初に施行すべき治療となってきています。また、必ずしもてんかんを発症するわけではありませんが、ピルビン酸脱水素酵素欠乏症においても同様のことがいわれています。さらに、結節硬化症、レット症候群の患者さんでもケトン食療法が推奨されています。
発作の減少、消失のみならず、ケトン食療法を受けた患者さんの中には発達や行動上の改善がみられる方もみえます。また、発作の悪化を引き起こすことなく、抗てんかん薬を減量、中止できる可能性もあります。これによって、抗てんかん薬の副作用が軽減できますし、さらに、行動上の改善も期待できます。
年長児や成人がケトン食を食べ続けることはかなりむずかしく、このため、当初、ケトン食療法は、主として乳幼児で行われていました。しかし、古典的ケトン食以外の方法が開発されて食事の味が普通の食事に近づき、年長児や成人でもケトン食療法をおこなうことができるようになってきています。そして、乳幼児よりは劣りますが、それなりの効果が報告されています(11~51歳(平均32歳)の難治てんかんの45%で50%以上の発作抑制(Nei M et al (2014))。
このように、ケトン食はいいことずくめのようですが、残念ながら、問題も山積みです。
まずは、副作用です。
導入時の副作用は先に述べましたが、ケトン食療法は最低2年間、続けるべきとされていますので(発作型にもよりますが、2年間続ければ、その後中止しても80%の患者さんで発作消失状態が保たれるという報告がなされています)さまざまな長期的な副作用にも留意する必要があります。高脂血症、成長障害、胃腸障害、腎結石、ビタミン欠乏、微量元素欠乏症(特に、セレン欠乏)、膵炎、易骨折性などです。ビタミン、微量元素の補充は必須です。腎結石に対してはクエン酸の併用で減少できるという報告もありますが、まだ、確証は得られていません。成長障害は乳幼児で必発とされています。大量のケトン体が産生されるかぎり成長への影響は避けることができないようで、ケトン比を下げても回避できないという報告もあります。いずれにしても、内分泌専門医、腎臓医、栄養士も含めさまざまな専門家の定期的なチェックが不可欠です。
しかし、最大の問題は、食事そのものです。
昔に比べ大幅に改善されたとはいえ、やはり、ケトン食療法は食事の楽しみを奪ってしまいます。

| 図24 ケトン食の栄養組成通常の食事、古典的ケトン食、低グリセミック指数食の総エネルギー摂取量に占める栄養組成を示す。ケトン食がいかに偏った食事かがわかる。Pfeifer et al(2008)改変 |
たとえば、誕生日にケーキを食べることすらできません。炭水化物制限のため、シロップ水剤、ドライシロップ剤、糖衣錠の薬さえ避けるべきとされていますから、ケーキの糖分などはもってのほかです。ちょっとぐらいと思うのですが、糖分をとって血糖が急激に上昇し、ケトン体が下がった途端、発作がぶり返すおそれがあります。もちろん、誕生日ケーキよりも発作抑制のほうが重要だという考えも成り立ちます。しかし、成長期の子どもに長期にわたって食事の楽しみを奪うというのは、やはり、ちょっと、考えものです。繰り返しになりますが、どんな疾患であれ、治療の目的は、普通の生活ができるようにすることです。そして、子どもの場合は、その子の潜在能力を最大限引き出す生育環境を整えることです。楽しみの伴わない食事を強要するケトン食療法は、やはり、治療の名に値しない面があるといわざるをえません。
実際、ケトン食療法は長続きしないことでも有名です。
患者さんやご家族が耐えられなくなり、中断に至ることが少なくないのです。ケトン食という難業に立ち向かうために、患者さん、患者さんの家族、治療に携わる人々が強固な信仰とまではいわなくとも、ストイックな信念を持ち続けることが必要です。しかし、その信念もどこかでもろくも崩れてしまうことも少なくありません。実際、ケトン食療法の効果が二重盲検法により評価されてこなかったのは、脱落例が多すぎて、きちんとした比較検討ができず、評価不能となってしまうからです。厳密なコントロールの下に行われている臨床試験においても、1年後には半数近くがケトン食を止めてしまっています(継続率52-56%)。
このこともあって、国際的にみると、ケトン食療法は、いまだ、てんかん治療の中で確固たる地位を占めているとはいえません。世界の多くの専門医はケトン食療法をどうにもならなくなったとき期待もせずに試みる「最終手段」ととらえているようです。まったく行っていない専門医も少なくありません。今までの話でお分かりのようにケトン食療法は人々がこのユニークな治療法をどのように捉えるかによってその盛衰を繰り返してきた面があります。そのユニークさ故に過度に期待する人もいれば、その「型破り」な面をうさんくさいとみる人もいます。その効果だけで治療としての生命が長らえられるのか、ちょっと、あやしいところがあります。
ケトン食の未来
このように、まだまだ問題を残しているケトン食療法ですが、今後、ますます広まっていく可能性も秘めているのも事実です。さらに工夫を加えて、食べやすいケトン食を作成することはできるでしょうし、何よりも、発作が止まり、精神の活発化が期待できることは、何ごとにも代え難い魅力です。実際、北米などでは、すでに、てんかん治療の「最終手段」ではなくなってきているようです。ある程度抗てんかん薬を試みた(2剤ぐらい)にもかかわらず十分な発作コントロールが得られない場合には、積極的に試みるべき治療法と位置づける病院、施設もでてきているといわれています。そのようにして治療経験が拡大すれば、より安全で「耐えやすい」食事がさらに開発されるかもしれません。
そして、ケトン食療法の作用機序が完全に解明されれば、より効率的で、より効果的な治療法に発展する可能性もあります。
前に申したように、なぜ、ケトン食がてんかん発作に効くのか、まだ、よくわかっていません。膨大な研究がなされていますが、肝心な点が解明されていないのです。少なくとも、その作用機序は当初考えられていたよりもずっと複雑怪奇なようです。ケトン体の神経機能や神経伝達物質への影響に加え、血糖濃度の安定化、ミトコンドリア機能の変化、脂肪酸の抗てんかん作用などの要因が複数絡み合っていて、そのうちどれが根幹をなしているのか、まだよく分かっていません。 はっきりしているのは、ケトン体の存在が発作コントロールに必須であるということだけです。しかし、ケトン体だけで抗てんかん作用を説明することもできません。たしかに、ケトン体は細胞膜の興奮性を鎮め、抑制性アミノ酸GABAの生成を高め、興奮性アミノ酸グルタミン酸の放出を抑えることが分かっています。しかし、それらが本当に発作抑制につながっているのかどうかに関して、はっきりとした結論は出ていません。ケトン比が1:1前後のさまざまなケトン食の変種がでたことからも分かるように、ケトン体の量と発作コントロールの間に明確な相関関係は今のところ認められていません。さまざまな動物実験も行われていますが、抗てんかん薬でみられるような意味合いでの発作コントロール作用はケトン食療法では見いだされていません。たとえば、抗てんかん薬とは異なり、ケトン体は海馬切片の興奮性や抑制機能には影響を与えないことが分かっています。こうしたことから、ケトン食療法は「魔女の杖」にすぎないのじゃないかと疑惑の目で見られることさえあります。
しかし、たしかに効くことは効くのです。
もしかしたら、従来考えられてきたてんかん発作抑制機序とは全く違うメカニズムが生体に存在していて、そこにケトン食は働いているのかもしれません。それが「魔法の杖」の正体なのかもしれません。もし、そうだとすれば、てんかん治療に関してケトン食療法は全く新しい地平を切り開いてくれる可能性を秘めていることになります。
さらに、最近、ケトン食療法は脳腫瘍をはじめとする癌の治療においても注目を浴びています。がん細胞は細胞分裂のために盛んにブドウ糖を取り込むことが知られています。そこで、ケトン食によってもたらされる高脂肪、低炭水化物が腫瘍の成長を妨げるかもしれないと期待されているのです。加えて、ケトン食によって末期がんの患者さんに心のやすらぎがもたらされ、不眠、食欲不振などの症状を和らげる効果も報告されています。また、認知症にも有効ではないかともいわれています。こうしたことを考えると、ケトン食療法はさまざまな可能性を秘めた魅力的な食事療法といえるでしょう。
| メモ7 ケトン食が普及しない原因として医者の問題を指摘する声もあります(吉永治美、小国弘量 (2018))。2種類抗てんかん薬を試みて発作がコントロールされなかったらケトン食を試みることを勧めているてんかん治療ガイドラインがあるにもかかわらず、多くの医師は、さらに別の抗てんかん薬をいろいろ試してから、最終的にケトン食にたどり着く傾向にあります。このため、ケトン食に対する印象が良くないままになっているのではないか、という指摘がなされているのです。一般的に、複数の薬剤を順次使用する場合、後から使用した薬剤の有効率は低く、その薬の印象が悪くなります。それと同じことがケトン食でも起きているのじゃないかというわけです。もし、治療初期にケトン食を試みていれば、より高い有効率が期待でき、抗てんかん薬の副作用を軽減することで、発作だけでなく、精神運動発達も良好なケースが増える可能性があります。そうした『成功体験』が重なれば、医者の目は見開かれ、もっとケトン食をやるようになるはずだ、というのです。たしかに、一理あります。ただ、そうなるためには、早期にケトン食を開始した方が、遅く開始するよりも、発作予後や精神運動発達予後もいいという研究結果が欲しいところですが、今のところ、そのような報告がなされていません。 |
最初に、てんかんの薬物治療は対症療法にすぎず、鉄欠乏性貧血に対する鉄剤投与のような根治治療ではないとご説明しました。そして、抗てんかん薬の作用機序が十分解明されていないため、戦略的な治療計画を立てることが難しいと述べました。どの薬を使うのか、薬が効かなかった場合、次にどの薬を使えばいいのか、どれだけの期間治療するのか――こうした当然の疑問に、今はまだ、きちんとお答えできません。これは、薬物治療に限ったことではありません。外科治療でもケトン食療法でも多かれ少なかれ言えることです。残念ながら、てんかん治療というのは、てんかんをもつ患者さんのさまざまな疑問にきちんと答えられない部分を数多く残しています。このため、てんかん治療に不信感を持たれている方もいらっしゃるかもしれません。
しかし、曖昧さが常につきまとうのがてんかん治療の今の姿なのです。
患者さんの疑問に充分答えられないのは、てんかんという病気、そして、脳という臓器の複雑さによるものだとカリフォルニア大学のローウェンシュタインは説明しています(Lowenstein. DH Pathways to discovery in epilepsy research: Rethinking the quest for Cures. Epilepsia 49: 1-7、 2008)
「3年前、空港のレストランで夫と一歳になる双児の子どもたちと食事をしていて、はじめて発作を起こした。この時、私の人生は混沌の奈落に落ちた。その時起きた発作、そして、その後繰り返した発作の数々。しかし、発作そのものは問題ではない。発作のさなか、わたしは意識がなく、何も知らないから。問題は、発作と発作の間。毎日、頭の中は幾度となく繰り返される同じ問いであふれかえる。今日は、発作なしでやっていけるかしら?子どもたちは大丈夫かしら?そもそも、よりによって、なぜ、こんなことが、わたしの身に降りかからなければいけなかったの?子どもたちもてんかんを発症するのかしら?以前と同じような元気が出てこないのは、なぜ?いつかは、こんなこともなくなるのかしら?」
本章の冒頭に掲げたてんかんをもつ1人の女性の溜息を例に挙げて、てんかんの患者さんやご家族は共通して次のような基本的疑問を抱いている、とローウェンシュタインは指摘します。
1. なぜてんかん発作が起きたのでしょう?
2. 最良の治療はなんでしょう?
3. なぜ、治療はうまくいっていないのでしょう?
4. いつになったら発作は消えてくれるのでしょう?
現時点では、これらの質問に次のように答えるしかない、とローエンシュタインはコメントしています。
1. なぜてんかん発作が起きたのでしょうか?
答え:はっきりとはわかりません。てんかん素因があるのかもしれませんが、それ以外の特定の病因があるのかもしれません
2. 最良の治療はなんですか?
答え:睡眠、食事に気を配り、それ以外にも、てんかん発作を起こしかねないような要因を避けていただいて、そのうえで、薬を飲んでみてください。抗てんかん薬は何種類もあります。しかし、治療をはじめる前から、この薬が最良だと予測することは不可能です
3. なぜ、治療はうまくいっていないのでしょう?
答え:ところが、それが、よくわからないのです
4. いつになったら発作は消えてくれるのでしょうか?
答え:じつは、それも、よくわからないのです
これは、てんかんに関してもっとも権威ある学術雑誌、Epilepsiaに掲載された総説の一節です。これが、最先端のてんかん学に身を置く人の密かな呟きなのです。実際には、世界中のてんかん専門医がこうした答えしかできなくてフラストレーションを募らせています。もちろん、患者さんの方はもっと不安、不満を抱いていらっしゃることでしょう。
こんなことは、たとえば、鉄欠乏性貧血の治療では考えられません。貧血の原因(鉄欠乏)も最良の治療(鉄補給)も自明ですし、治療は「うまくいき」、数か月のうちに貧血は消失します。
これに対し、てんかんの治療では、最良の治療がなんであるのか事前には知り得ません。とにかくやってみるしかありません。もちろん、治療がうまくいくかどうかもわかりません。そして、数年たってもまだてんかん発作が続いていることだってありえます。
しかし、そうはいっても、てんかんの治療が格段の進歩をしてきたことも事実です。抗てんかん薬がほとんどなかった60~70年前には、てんかん発作を目撃する機会は今と比べてかなり多かったようです。前にも申しましたが、当時は、小学校などの教室でてんかんを起こす子が、一クラスに一人ぐらいはいたようです。小児てんかんの発症率からいえば、たしかに、そうだったでしょう。しかし、いまは、70%とはいえ、てんかん発作をコントロール可能です。てんかん発作をみたことのある人はめったにいないだろうと思います(わたしの外来にかよってみえる患者さんの中に、学校でてんかん発作を目撃した中学生の方がいらっしゃいました。授業中、先生がてんかん発作を起こしたのです。てんかん発作ってこうなるんだと知ってビックリしたと話してくれました)。それなりの進歩はしてきているのです。
また、昔は、てんかんに罹患して、発作を繰り返すうちに知的に退行し、精神症状も出現、廃人同様となって精神病院などに収容される患者さんが大勢いました。しかし、今では、そうした患者さんもほとんどみられなくなっています。その原因の一つは神経梅毒のようにてんかん発症とともに認知機能が低下する病気がなくなったためだと思われますが、一方で、薬物治療によって発作コントロールが可能になったことも大きく寄与していると推定されます。ブロムがてんかん治療に使われるようになってから約1世紀半、フェノバルビタールが20世紀初頭に抗てんかん薬として登場して以来、約100年、てんかん治療は着実に進歩してきました。その進歩は今も続いています。そして、てんかんの全てをカバーしているとはいえませんが、てんかん外科の切除術や代謝性疾患に関連したビタミンB6、ビオチン療法といった根治治療もあります。あるいは、結節性硬化症のてんかんに対するmTOR阻害薬による治療といった疾患修飾治療もありますし、遺伝子治療も今後急速に発展するかもしれません。てんかんの治療が鉄欠乏性貧血の治療と肩を並べる日がこないとはいえないのです。
参考資料
- 阿部あかね(2010) 1970 年代日本における精神医療改革運動と反精神医学. Core Ethics 6:1-11
- 井上有史、西田卓司 日本てんかん学会ガイドライン作成委員会 (2004) てんかん治療の Expert Consensus. てんかん研究22:128-39
- 臼井桂子(2011) Wadaテストによる言語・記憶機能検査―てんかん外科の手術前検査における役割―. Epilepsy 5:29-35
- 臺弘(1972)精神医学の思想――医療の方法を求めて.筑摩書房
- 臺弘(2015)誰が風をみたか・増補版:ある精神科医の生涯.星和書店
- 大熊一夫 (1973) ルポ・精神病棟 朝日新聞社
- 笠原嘉(1976)レインの反精神医学について. 臨床精神医学 5: 675-682
- 亀山茂樹(2009)視床下部過誤腫に対する低位温熱凝固術 Epilepsy 3 (1) :45-49
- 亀山茂樹、川合謙介(2016)てんかん外科手技の発展. 日本てんかん学会50周年記念編集委員会 編「日本てんかん学会の歴史:日本てんかん学会50周年を記念して」 p62-63、診断と治療社
- 徳田御稔(1955) 二つの遺伝学 理論社
- マーク・カーランスキー (2006) 越智道雄監修、来住道子訳 1968:世界が揺れた年 ソニー・マガジンズ
- ケン・キージー(1962) 岩本巌訳 カッコーの巣の上で パンローリング株式会社
- 静岡てんかん・神経医療センター・情報センター https://shizuokamind.hosp.go.jp/epilepsy-info/information-center/ https://square.umin.ac.jp/jes/epilepsy-detail/guideline.html (2021年2月7日閲覧)(てんかん発作介助、海外渡航のアドバイス、成人難治てんかん、てんかん外科治療の適応と手術成績など、てんかんにかんするさまざまな情報かわかりやすくコンパクトに解説されています。この文章を書くにあたってもずいぶん参考にさせていただきました)。
- 杉浦嘉泰 、宇川義一(2017).てんかんとイオンチャンネル.臨床神経学 57:1-8
- 寺田清人(2011) 発作時の側方微候 Epilepsy 5 (1) :29-41
- 中川栄二、熊谷拓也(2025)癲癇重積状態に移行するおそれのある発作に対する迅速治療の提案.てんかん研究 43:75-83
- 中村禎里 (2017) 日本のルィセンコ論争(新版) みすず書房
- 日本神経学会監修、「てんかん診療ガイドライン」作成委員会編集(2018)てんかん診療ガイドライン2018 医学書院
- 橳島次郎 (2012)精神を切る手術:脳に分け入る科学の歴史 岩波書店
- フィリプ・ヒルツ(1997)竹内和世訳 記憶の亡霊:なぜヘンリー・Mの記憶は消えたのか 白楊社
- ローレン・スタイナー(2005) 岩坂彰訳 心は実験できるか:20世紀心理学実験物語 紀伊國屋書店
- 舛添要一(2022)スターリンの正体: ヒトラーより残虐な男 小学館
- 松本理器ら (2019) てんかん外科における最新のてんかん診断学 日外誌 28:316-325
- 丸山博 編 (2010) ケトン食の本:奇跡の食餌療法. 第1出版株式会社
- 三原忠紘、馬場啓至(2016)日本のてんかん外科の歴史 日本てんかん学会50周年記念編集委員会 編「日本てんかん学会の歴史:日本てんかん学科50周年を記念して」 p59-61診断と治療社
- 森山公夫 (1975)現代精神医学解体の論理.岩崎学術出版社
- レイン RD (1973)笠原嘉監修、阪本健二、志貴春彦訳. ひき裂かれた自己. みすず書房
- 吉永治美、小国弘量 (2018)ケトン食療法の有効性と課題 脳と発達 50:203-5
- Abou-Khalil WS et al (2019) Update on Antiepileptic Drugs 2019 Continuum (MINNEAP MINN) 25 (2, EPILEPSY):508 – 536.
- Berg AT et al. (1999). Classification of childhood epilepsy syndromes in newly diagnosed epilepsy: interrater agreement and reasons for disagreement. Epilepsia 40:439-44.
- Bratz E (1899) Ammonshornbefunde der epileptischen. Arch Psychiatr Nervenkr 31: 820-36.
- Broberg G, Nils Roll-Hansen ed.(2005) Eugenics and the Welfare State sterilization in Denmark, Sweden, Norway, and Finland 2nd Edition. University of California Press.
- Devi N, et al.(2023) Efficacy and Safety of Dietary Therapies for Childhood Drug-Resistant Epilepsy: A Systematic Review and Network Meta-analysis. JAMA Pediatr. 2023 Jan 30. https://jamanetwork.com/journals/jamapediatrics/article-abstract/2800777 Online ahead of print.
- van der Louw E et al (2016) Ketogenic Diet guidelines for infants with refractory epilepsy. Eur J Paediatr Neurol 20:798-809
- Engel J Jret al (1993) Outcome with respect to epileptic seizures. In Engel J Jr, ed. Surgical treatment of the epilepsies. New York: Raven Press 609–21.
- Engel JJ (2018)The current place of epilepsy surgery. Curr Opin Neurol 31: 192–197
- Engel JJ (2019)Evolution of concepts in epilepsy surgery. Epileptic Disord 21 : 391-409
- Englot DJ (2018) A modern epilepsy surgery treatment algorithm: incorporating traditional and emerging technologies. Epilepsy Behav 80: 68–74
- Falconer MA, Taylor DC (1968) Surgical treatment of drug-resistant epilepsy due to mesial temporal sclerosis. Etiology and significance Arch Neuro 19:353-61
- Frauscher B et al (2017) High-frequency oscillations: The state of clinical research. Epilepsia 58: 1316–1329.
- Freeman JM et al. The Ketogenic Diet: a treatment for children and other s with epilepsy 4th ed. Demos Medical Pub, New York, 2006.
- Guelpa G, Marie A. La lutte contre L’epilepsie par la desintoxication et par la reeducation alimentaire. Revue de Therapie Medico-Chirugicale 1911, 78:8-13
- Geyelin HR (1921). Fasting as a method for treating epilepsy. Med Rec 99:1037-9
- Hauser WA et al (1998). Risk of recurrent seizures after two unprovoked seizures. N Engl J Med 338:426-34
- González HFJ et al (2019 ) Vagus Nerve Stimulation for the Treatment of Epilepsy. Neurosurg Clin N Am 30: 219–230
- Huttenlocher PR et al (1971) Medium-chain triglycerides as a therapy for intractable childhood epilepsy. Neurology 21 :1097-103
- Jacob S & Nair AB (2016) Drugs R D An updated overview on therapeutic drug monitoring of recent antiepileptic drugs 16:303–316
- Jenkins DJ et al (1981) Glycemic index of foods: a physiological basis for carbohydrate exchange. Am J Clin Nutr 34:362–366.
- Karceski S. et al The expert consensus guideline series: treatment of epilepsy. Epilepsy & Behavior 2001;2 (Suppl) : A1-A50
- Kohlhase K et al (2021) Comparison of minimally invasive and traditional surgical approaches for refractory mesial temporal lobe epilepsy: a systematic review and meta-analysis of outcomes. Eplepsia Version of Record online:03 March 2021 1-15.
- Kossoff EH et al (2008)Optimal clinical management of children receiving the ketogenic diet: Recommendations of the International Ketogenic Diet Study Group. Epilepsia 50:304-17
- Kossof EH et al (2018) Optimal clinical management of children receiving dietary therapies for epilepsy: Updated recommendations of the International Ketogenic Diet Study Group Epilepsia Open, 3(2):175–192
- Lowenstein DH (2008) Pathways to discovery in epilepsy research: Rethinking the quest for Cures. Epilepsia 49: 1-7、
- Kwan P, Brodie MJ (2000). Early identification of refractory epilepsy. N Engl J Med 342(5):314-9.
- Kwan P et al. (2010). Definition of drug resistant epilepsy : consensus proposal by the ad hoc Task Force of the ILAE Commission on Therapeutic Strategies. Epilepsia 51:1069-77.
- Leblanc R (2019) Against the Current: Wilder Penfield, the Frontal Lobes and Psychosurgery. Can J Neurol Sci 46: 585–590.
- Lichterman L et al. (2022) Chapter 1 – A comparative history of psychosurgery. Prog Brain Res 270: 1-31.
- Lüders HO. et al. (2006) The epileptogenic zone: general principles. Epileptic Disord 8 (Suppl. 2): S1-9
- Working Group: *Jo M. Wilmshurst, †Wilmshurst JM (2015). Summary of recommendation the management of infantile seizures: Task Force Report for the ILAE Commission of Pediatrics. Epilepsia 56:1185-97
- Lyons L. et al. (2020) Use of ketogenic diet therapy in infants with epilepsy: A systematic review and meta-analysis. Epilepsia 61:1261-81
- Meldrum BS and Horton RW(1973) Physiology of status epilepticus in primates. Arch Neurol 28:1–9
- Mihara T et al (2004) Long-term seizure outcome following resective surgery at National Epilepsy Center in shizuoka, Japan. Psychiat Clin Neuroscience 58: S22-S25
- Miler B, Penfield W. The effect of hippocampal lesions on recent memory. Trans Am Neurol Assoc 1955-1956 (80th Meeting):42-8.
- Nei M. et al (2014) Ketogenic diet in adolescents and adults with epilepsy. Seizure 23:439–42
- Oka et al. (2006). Prevalence of childhood epilepsy and distribution of epileptic syndromes: a population-based survey in Okayama, Japan. Epilepsia 47:626-30.
- Payne NE et al (2011) The ketogenic and related diets in adolescents and adults: a review. Epilepsia 52:1941-8.
- Pfeifer HH, Thiele EA (2005) Low-glycemic-index treatment: a liberalized ketogenic diet for treatment of intractable epilepsy. Neurology 65:1810-2.
- Polkey CE, Smith MC (2008) Multiple subpial transections and other interventions. In: Engel J Jr, Pedley TA. Epilepsy: A Comprehensive Textbook. 2nd Ed. Lippincott Williams & Wilkins:
Philadelphia, 1921-8. - Rosenhan DL (1973) On being sane in insane places. Science 179 (4070):250-8.
- Sampaio LPB(2016) Ketogenic diet and epilepsy. Arq Neuropsiquiatr 74:842-8
- Sano K, Malamud N (1953) Clinical significance of sclerosis of the cornu ammonis: ictal psychic phenomena. Arch Neurol Psychiatry 70:40-53
- Schmidt M et al (2011) Effects of a ketogenic diet on the quality of life in 16 patients with advanced cancer: A pilot trial. Nutr Metab (Lond) 27:54.
- Scottish Intercollegiate Guidelines Network. Diagnosis and Management of Epilepsy in Adults: A national clinical guideline.
- Scoville WB (1954) The Limbic Lobe in Man. J Neurosurg 11:64-6
- Scoville WB & Millner B (1957) Loss of recent memory after bilateral hippocampal lesions. J Neurol Neurosurg Psychiat 20:11-21
- Sperling MR et al (2016) A reappraisal of mortality after epilepsy surgery. Neurology 86:1938–44
- Taylor D (1993) Epilepsy as a chronic sickness: remediating its impact. In: Engel J Jr. Surgical Treatment of the Epilepsies. 2nd
Ed. Raven Press: New York:11-22 - Trinka E et l (2015) A definition and classification of status epilepticus – Report of the ILAE Task Force on Classification of Status Epilepticus. Epilepsia 56:1515–23
- Viensky JA (2002) A Glimpse of our past – Sir Victor Alexander Haden Horsley (1857–1916): Neurosurgeon and Neuroscientist. Clinical Anatomy 15:171–172
- Wada J (1949) A new method for determination of the side of cerebral speech dominance: a preliminary report on the intra-carotid injection of sodium amytal in man, Igaku to Seibutsugaku Medicine and Biology 14: 221-2.
- Wada J, Rasmussen T (1960) Intracarotid injection of sodium amytal for the lateralization of cerebral speech dominance. J Neurosurg 106 (2007):1117-1133
- West S et al (2016) Surgery for epilepsy: a systematic review of current evidence.
Epileptic Discord 18: 113-21 - Wheless J W (2008) History of the ketogenic diet. Epilepsia 49 (Suppl. 8):3–5
- Wieser HG (2001) Commission on Neurosurgery of the International League Against Epilepsy (ILAE) 1997–2001: ILAE Commission Report Proposal for a New Classification of Outcome with Respect to Epileptic Seizures Following Epilepsy Surgery. Epilepsia 42:282–286
- Wilder RM (1921) Effects of ketonuria on the course of epilepsy. Mayo Clin Bull 2:307-14
- Zaveri HP et al (2020) Controversies on the network theory of epilepsy: Debates held during the ICTALS 2019 conference Seizure 78: 78–85
- Zuccoli G et a l (2010). Metabolic management of glioblastoma multiforme using standard therapy together with a restricted ketogenic diet: Case Report. Nutr Metab (Lond) 22:33
